
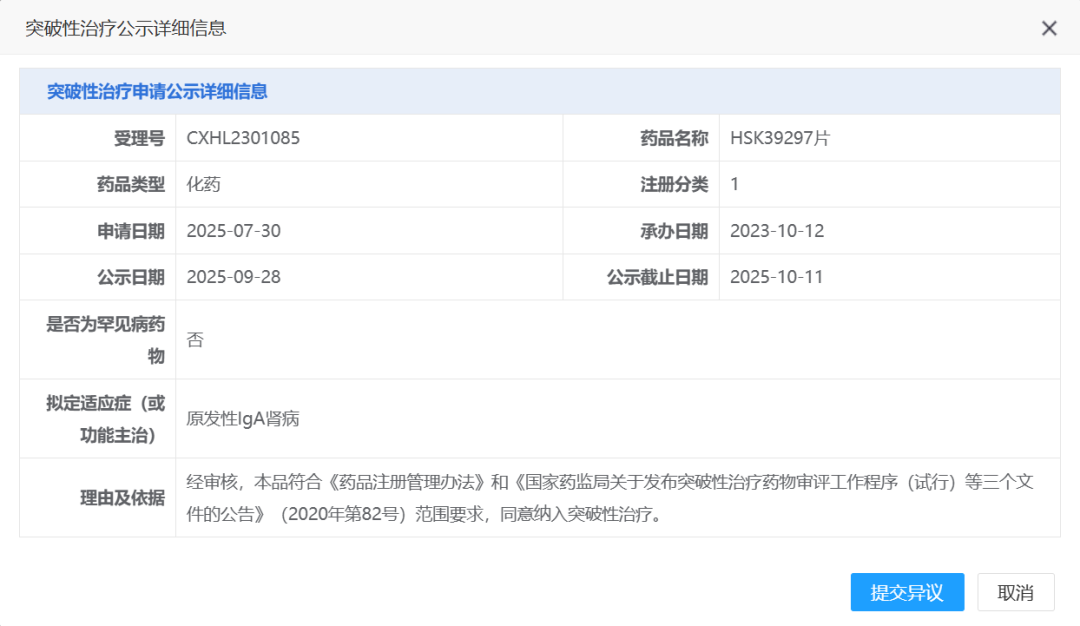
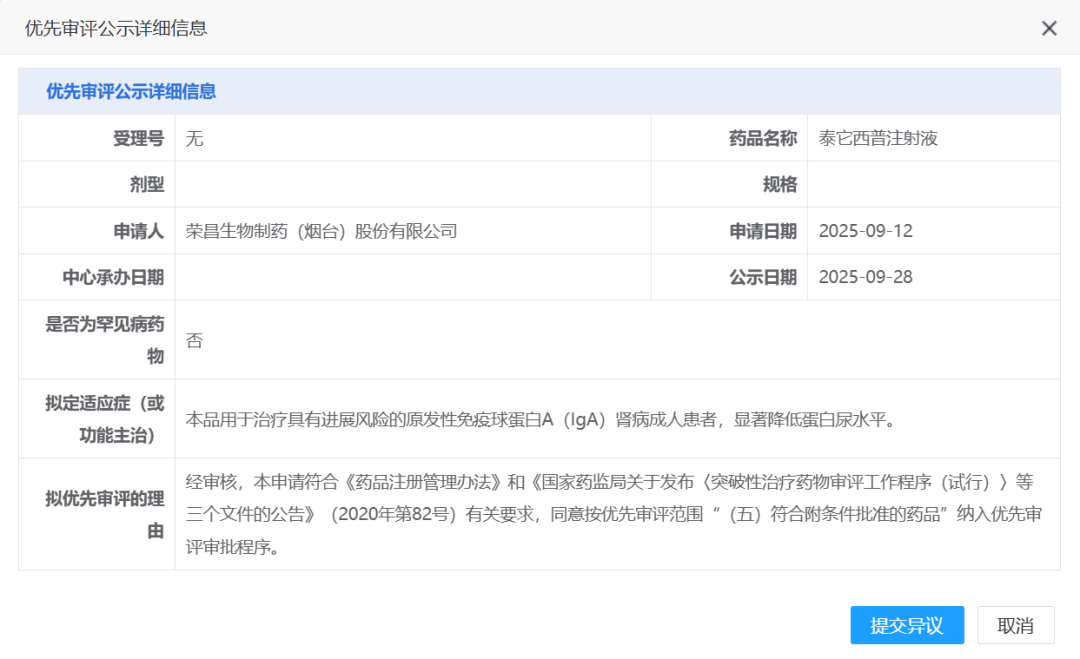
近日(9月28日),国家药品监督管理局药品审评中心(CDE)官网相继公示了两则消息:海思科自主研发的1类创新药HSK39297片拟纳入突破性治疗品种,用于原发性IgA肾病;荣昌生物的泰它西普拟纳入优先审评,针对具有进展风险的IgA肾病成人患者,显著降低蛋白尿水平。这两项进展意味着我国在IgA肾病靶向治疗领域实现关键突破,也为全球数百万患者带来了新希望。
一、IgA肾病——沉默的流行病,亟需创新解法
IgA肾病是全球最常见的原发性肾小球疾病,也是导致终末期肾病(尿毒症)的首要病因。据弗若斯特沙利文测算,全球患者将于2030年突破1016万人,其中我国患者达237万,年新增超10万人。该病的核心病理特征为免疫球蛋白A(IgA)在肾小球系膜区异常沉积,临床表现为反复血尿、蛋白尿,约30%的患者在确诊10-20年内进展至尿毒症,需依赖透析或肾移植维持生命。
长期以来,临床治疗依赖RAS抑制剂(如ACEI/ARB)、糖皮质激素等方案,但存在疗效局限或副作用风险。例如,传统免疫抑制疗法虽能缓解症状,却可能引发高血压、骨质疏松等严重不良反应。全球范围内,针对疾病核心机制的靶向治疗手段始终处于空白状态,患者迫切需要更安全、有效的创新药物。
二、海思科HSK39297:补体靶向治疗,直击疾病核心
HSK39297片是一种高效、高选择性的口服补体因子B(CFB)抑制剂,作用于补体旁路途径。研究证实,补体旁路途径异常激活是IgA肾病进展的关键推手,而CFB作为该途径的核心调控分子,其活性异常会直接导致肾小球炎症损伤与纤维化。通过特异性抑制CFB,HSK39297可从源头阻断补体级联反应,减少IgA沉积引发的免疫损伤。
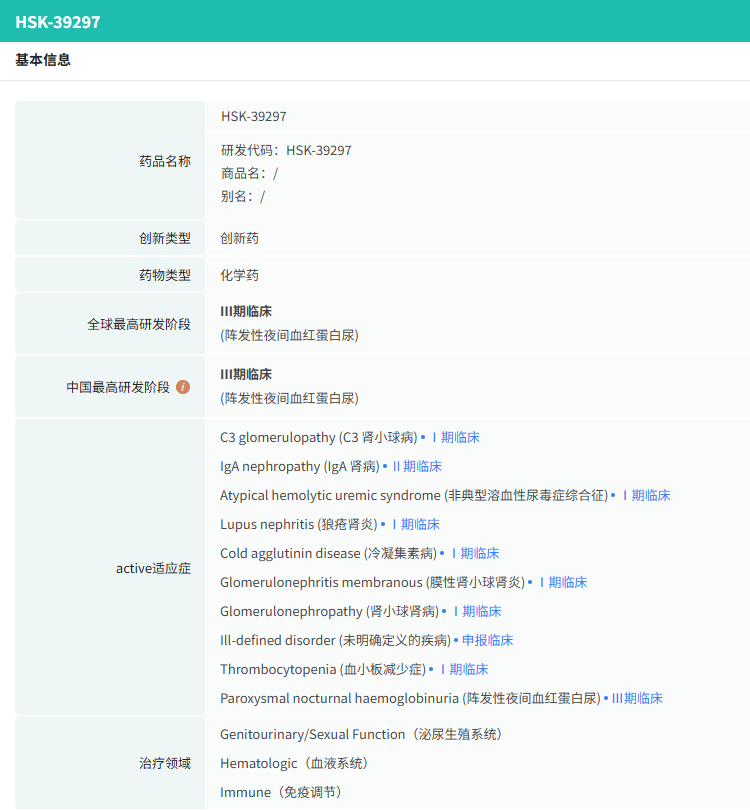
截图来源:摩熵医药全球药物研发数据库
2023年10月,HSK39297片首次获临床试验受理,同年12月完成Ⅰ期临床首例受试者入组,评估其在健康人群中的安全性与药代动力学特征,98例受试者研究结果为后续开发奠定基础。
2024年8月,HSK39297片针对IgA肾病的Ⅱ期临床试验正式启动,采用随机、双盲、安慰剂平行对照设计,纳入200余例受试者,分层分析不同剂量组(50mg BID、100mg BID、200mg QD)的疗效与安全性。
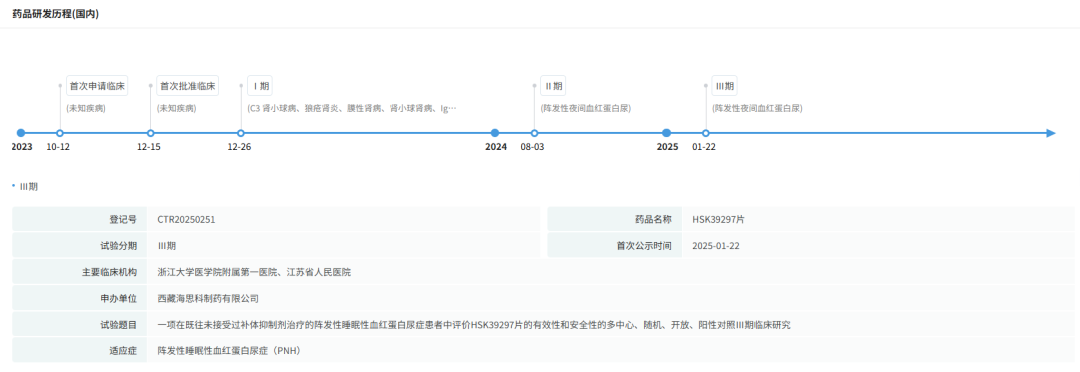
截图来源:摩熵医药全球药物研发数据库
此次HSK39297片拟纳入突破性治疗品种,将进一步加速临床开发进程。
目前,IgA肾病创新药赛道呈现“靶点聚焦、中外竞速”的特点。国内企业中,部分企业聚焦JAK抑制剂等靶点,但多处于临床早期。HSK39297片若成功上市,将成为首个国产CFB抑制剂类IgA肾病治疗药,填补全球补体靶向治疗领域的空白。其与临床常用药吉非罗齐合用的安全性研究显示,药物相互作用可控,为未来联用提供了数据支撑。
三、荣昌生物泰它西普:双靶点抑制,重塑免疫平衡
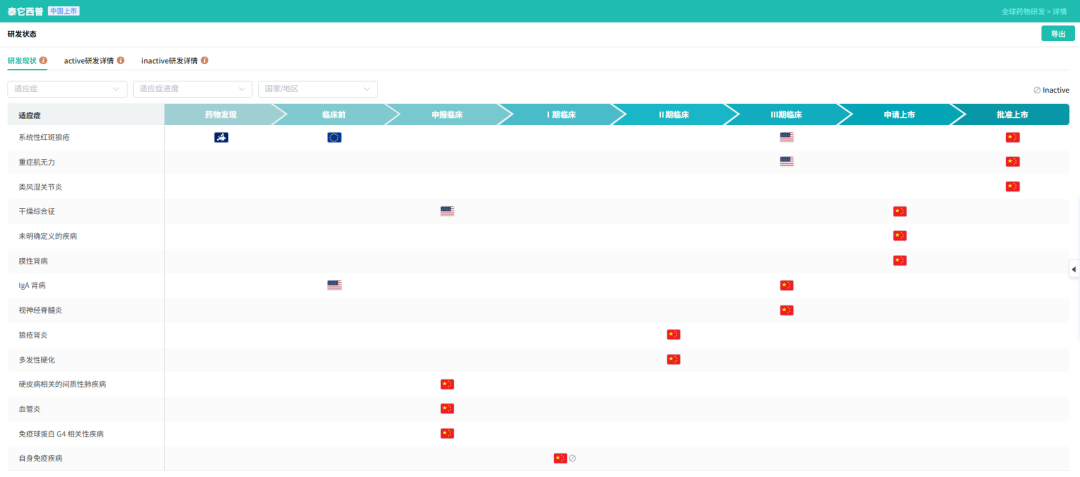
泰它西普是目前全球唯一可同时抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)的药物。这两种细胞因子在IgA肾病患者中的水平显著高于正常人群,是疾病发生的关键驱动因素。通过抑制BLyS和APRIL,泰它西普可减少B细胞增殖、降低浆细胞数量及异常免疫球蛋白生成,从源头阻断免疫复合物沉积,减轻肾脏免疫炎症反应。
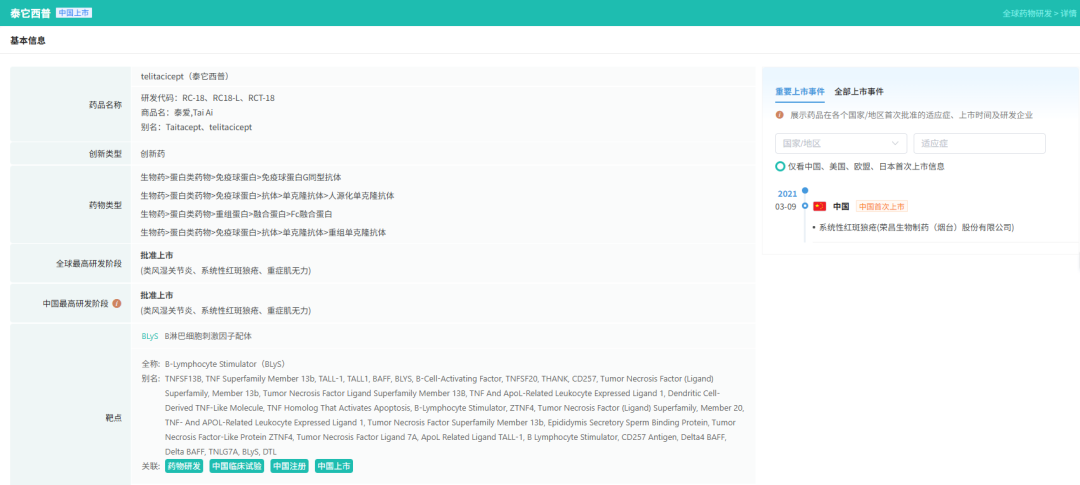
截图来源:摩熵医药全球药物研发数据库
2025年8月,荣昌生物宣布泰它西普治疗IgA肾病的国内Ⅲ期研究达成A阶段主要终点。研究结果显示,与安慰剂组相比,泰它西普组患者在治疗39周时24小时尿蛋白肌酐比值(UPCR)降低了55%(P<0.0001),且表现出良好的耐受性和安全性。9月28日,泰它西普拟纳入优先审评品种,加速了药物上市进程。
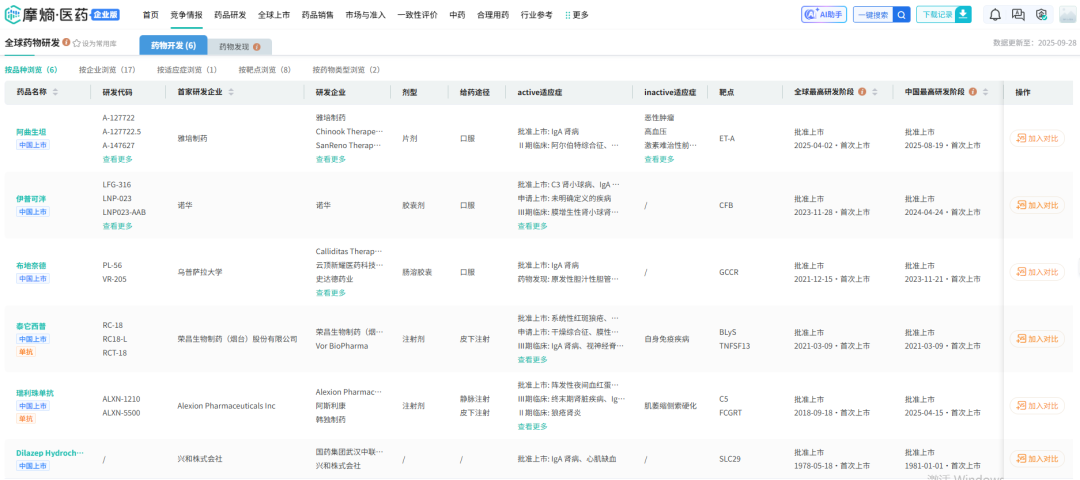
据摩熵医药数据库显示,泰它西普2025年上半年全终端医院销售额就已突破了4.2亿元,较去年增长了88.92%,其市场潜力不容小觑。












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论