
9月11日,石药集团(01093.HK)与康宁杰瑞(09966.HK)联合宣布:双方合作开发的全球首创抗HER2双特异性抗体药物 KN026(安尼妥单抗注射液)新药上市申请(NDA)正式获国家药品监督管理局(NMPA)受理。此次受理的适应症为:联合化疗用于至少接受过一种系统性治疗(必须包含曲妥珠单抗联合化疗)失败的HER2阳性局部晚期、复发或转移性胃/胃-食管结合部腺癌(GC/GEJ)。

截图来源:石药集团-官方公告

截图来源:康宁杰瑞生物制药-官方公告
HER2(人表皮生长因子受体2)是乳腺癌、胃癌等实体瘤的关键驱动基因,但针对HER2阳性胃癌的二线治疗长期面临无药可用的困境。传统化疗方案疗效有限,中位总生存期(OS)不足1年,且患者耐受性差。尽管曲妥珠单抗(赫赛汀)已获批用于胃癌一线治疗,但二线治疗中缺乏有效靶向药物,临床需求亟待满足。
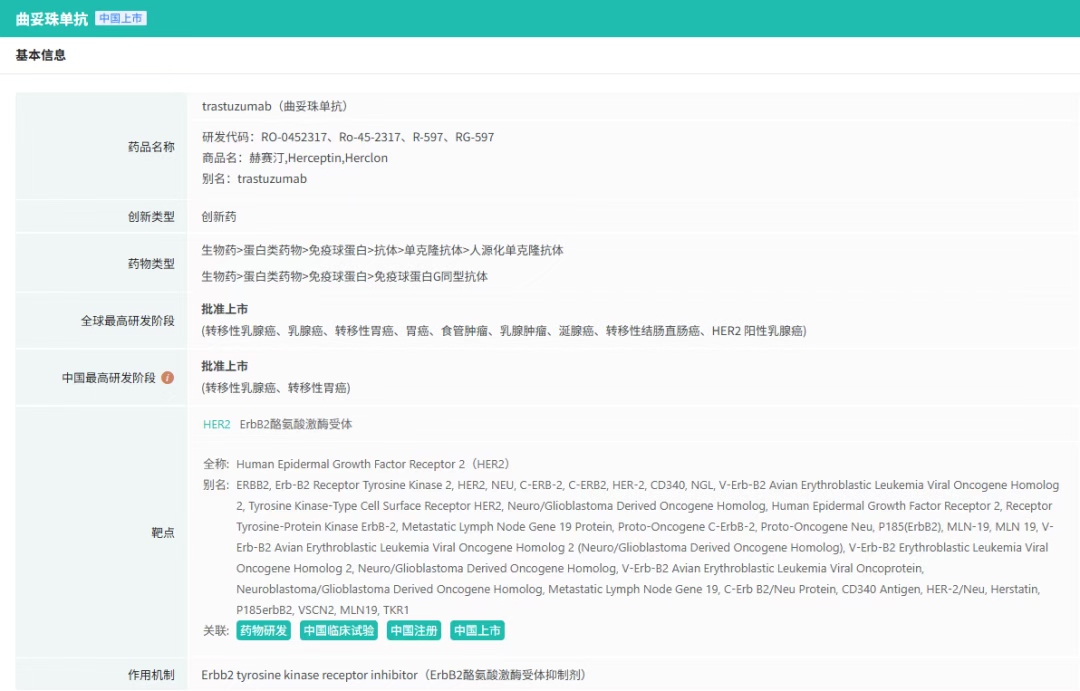
截图来源:摩熵医药-全球药物研发数据库
KN026的突破性意义在于:它是国内首个在胃癌二线适应症中获得阳性结果的抗HER2双特异性抗体药物。根据关键II/III期临床试验(KC-WISE)期中分析数据:
疗效显著:KN026联合化疗的客观缓解率(ORR)达40.0%,中位无进展生存期(PFS)延长至8.6个月,中位总生存期(OS)突破13.2个月,较现有标准治疗提升超40%;
安全性优异:心脏毒性发生率低于1%,免疫原性低,未新增安全性风险,患者生活质量显著改善。
综上,与现有标准治疗相比,KN026联合化疗显著延长了患者的生存期,且安全性良好,心脏毒性发生率低,免疫原性低。这一数据不仅验证了KN026的临床价值,更为其未来商业化奠定了坚实基础。
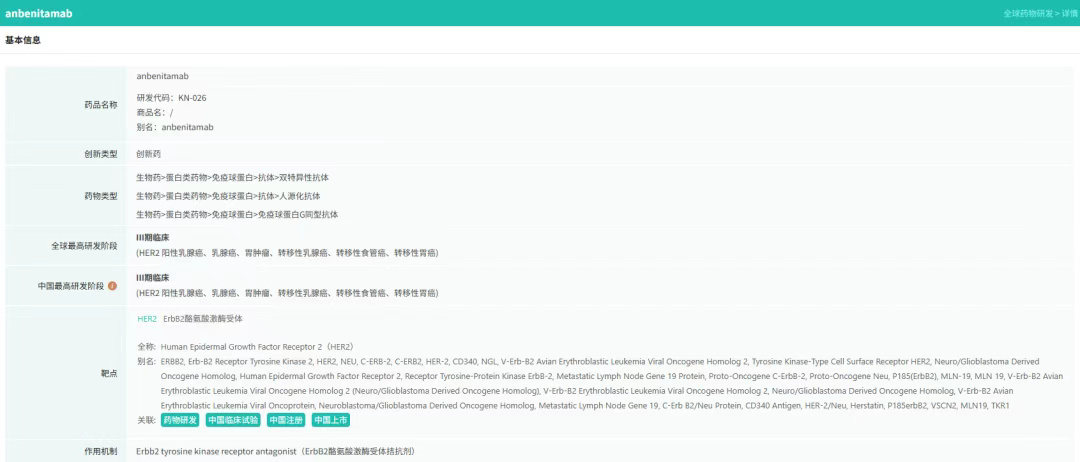
截图来源:摩熵医药-全球药物研发数据库
KN026的研发始于康宁杰瑞的实验室,2021年8月,石药集团以10亿元总金额引进KN026的中国权益,双方开启合作研发。此后,KN026的研发进程加速推进:2024年欧洲肿瘤内科学会(ESMO)大会上,II期临床试验结果首次公布,验证了其疗效与安全性;2025年9月7日,基于关键II/III期临床试验(KC-WISE)的期中分析结果,石药集团向国家药监局递交新药上市申请;2025年9月11日,上市申请正式获得受理。
此外,值得注意的是石药集团与康宁杰瑞的合作也并未止步于胃癌二线治疗。根据公告,KN026正在开展多项III期临床试验,包括:
- 联合多西他赛(白蛋白结合型)一线治疗HER2阳性乳腺癌;
- 联合化疗二线及以上治疗HER2阳性胃/胃-食管结合部腺癌;
- 联合多西他赛(白蛋白结合型)针对乳腺癌的新辅助治疗。
若这些适应症陆续获批,KN026的市场空间将进一步扩大。同时,石药集团于2024年9月以30.3亿元总金额(预付款3.9亿元)还引进了HER2双抗ADC新药JSKN003的中国权益,显示出了其在HER2靶向治疗领域的长期布局。

截图来源:摩熵医药-全球医药交易数据库
小结
KN026的新药上市申请受理,不仅填补了国内HER2阳性胃癌二线治疗的治疗空白,更通过双靶点设计、适应症扩展等优势,展现了创新药的巨大潜力。随着审评进程的推进,KN026有望在不久的将来正式上市,为更多患者带来生存希望。











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论