
近日(20250912),罗氏在clinical trials网站上,登记了一项关于Aβ抗体药物trontinemab(anti-Aβ/TfR1),在早期症状阿尔茨海默病受试者中,启动两项三期临床试验NCT07169578和NCT07170150的研究信息,这两项临床都预计于10月27日启动,分别入组人数为800例,这也意味着该药物迈入临床阶段的最后时刻,距离上市已经不远。


关于TRONTIER 21和TRONTIER 2的区别:二者同样采用随机、双盲、安慰剂对照的设计,但在具体的招募标准、样本量、研究中心分布等方面TRONTIER 2可能与TRONTIER 1有所不同,以确保研究结果的可靠性和广泛适用性。


一、关于trontinemab
Trontinemab是罗氏开发的新型重磅Aβ抗体药物,其除了采用独特的Aβ抗原表位,同时采用了Brainshuttle技术,通过偶联能结合Transferrin Receptor转铁蛋白受体的模块,得以大幅提高穿透血脑屏障(BBB)的能力,提高到达脑部的分布能力。
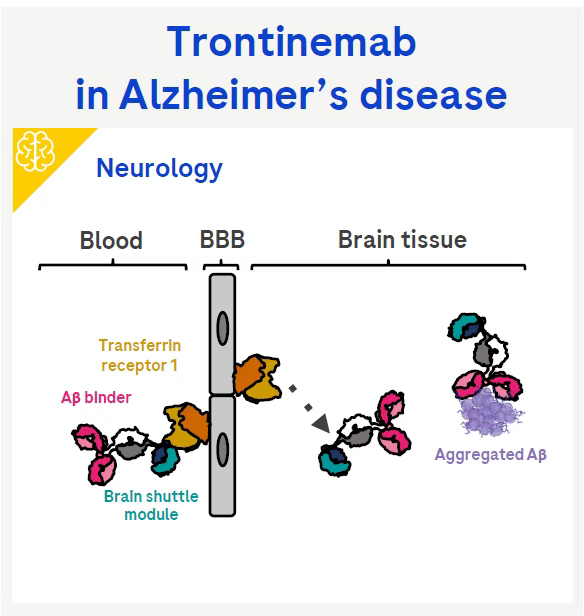
具体来讲,trontinemab是一种双特异性“2+1”单克隆抗体,其靶点主要包括以下两个:
淀粉样蛋白β(Aβ):Aβ是阿尔茨海默病(AD)的关键病理特征之一。在AD患者的大脑中,Aβ会异常聚集形成淀粉样蛋白斑块,这些斑块会干扰神经细胞之间的信号传递,导致神经细胞功能障碍和死亡,进而引发认知功能下降和记忆丧失等症状。
转铁蛋白受体1(TfR1):TfR1是一种跨膜蛋白,主要负责在细胞表面介导铁的摄取。在中枢神经系统中,TfR1在血脑屏障(BBB)的内皮细胞上高表达,是药物进入大脑的重要靶点之一。BBB是一种选择性通透的屏障,能够阻止大多数大分子药物进入大脑,这给AD等中枢神经系统疾病的治疗带来了很大的挑战。
作用机制:Trontinemab通过其抗Aβ抗体片段与Aβ斑块特异性结合,能够识别并结合Aβ的特定表位。这种结合可以触发免疫细胞的Fc受体介导的吞噬作用,从而促进Aβ斑块的清除,减少大脑中Aβ的积累,延缓或改善AD患者的认知功能衰退;另一方面,trontinemab通过其抗TfR1抗体片段与TfR1结合,利用转铁蛋白受体介导的转运机制,使药物能够更有效地穿过BBB,进入大脑。
这种“Brainshuttle”技术使得trontinemab在低剂量下就能在中枢神经系统中实现高暴露量,从而更有效地清除大脑中的Aβ斑块,同时降低了因高剂量给药而带来的副作用风险,如淀粉样蛋白相关成像异常(ARIA)等。
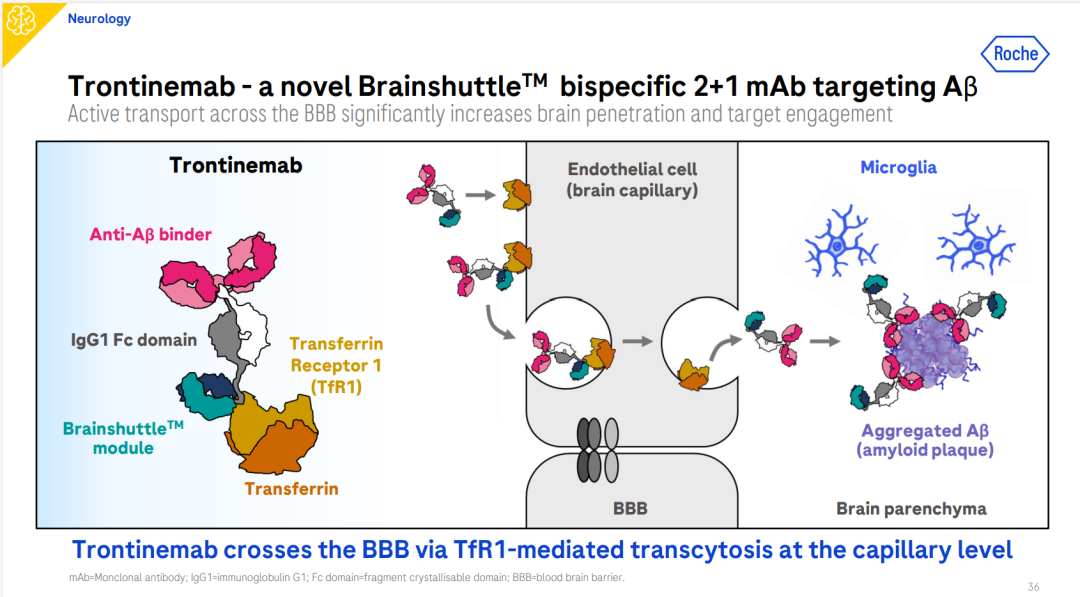
Brainshuttle技术是罗氏的一种创新的药物递送技术,主要用于提高大分子药物(如抗体)穿越血脑屏障(BBB)的能力,从而有效递送药物至中枢神经系统。
二、关于Brainshuttle技术
Brainshuttle技术通过在抗体上融合一个针对TfR1的抗体片段,使药物能够与TfR1结合。当药物与TfR1结合后,会形成内体隔室,内体隔室通过细胞质并最终通过转胞吞作用进入大脑。这一过程使得药物能够主动、快速地穿越血脑屏障。在临床试验中,使用Brainshuttle技术的Trontinemab在3-6个月内即可清除脑内淀粉样蛋白斑块,而传统抗体通常需要12-18个月。
1、Trontinemab临床I/IIb结果

不同剂量(1.8 mg/kg和3.6 mg/kg)的trontinemab在不同时间点(BL, D50, D78, D106, D196)对淀粉样蛋白水平的影响不同:
1.8 mg/kg和3.6 mg/kg剂量的trontinemab均显示出快速和显著的淀粉样蛋白清除效果,其中,81%的患者(3.6 mg/kg)在28周内实现了淀粉样蛋白PET阴性。65%的患者(1.8 mg/kg)在28周内实现了淀粉样蛋白PET阴性。
不同剂量(1.8 mg/kg和3.6 mg/kg)的trontinemab在临床试验中的安全性数据,特别是淀粉样蛋白相关成像异常(ARIA)的发生率:
结果显示安全性和耐受性良好,ARIA(淀粉样蛋白相关成像异常)发生率低,贫血有限且短暂,输液反应(IRR)可控。
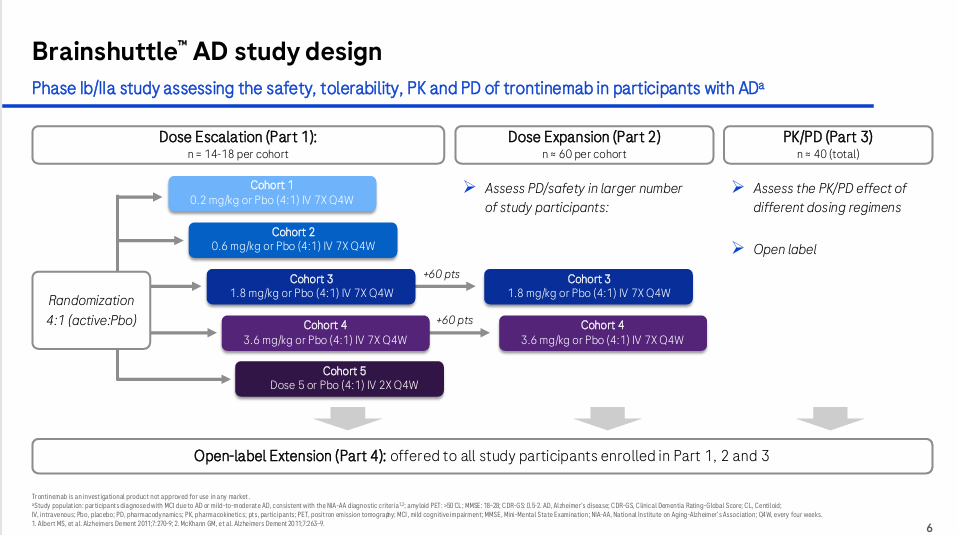
2、Trontinemab的最新临床结果
在2025年7月的AAIC上,罗氏公布了trontinemab治疗阿尔茨海默病(AD)的扩展期最新临床数据。

数据主要来自队列3(1.8 mg/kg)和4(3.6 mg/kg)的患者,共计149人。
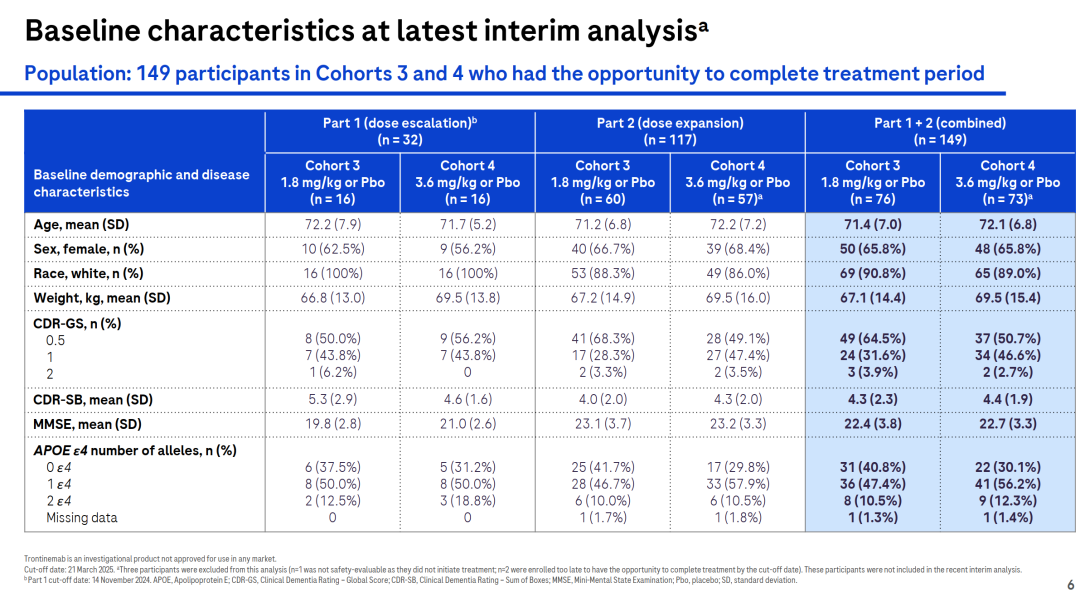
在先前的报道中,trontinemab在1.8 mg/kg和3.6 mg/kg剂量下,与安慰剂相比,在治疗12周和28周后,能够迅速且显著地减少淀粉样蛋白。
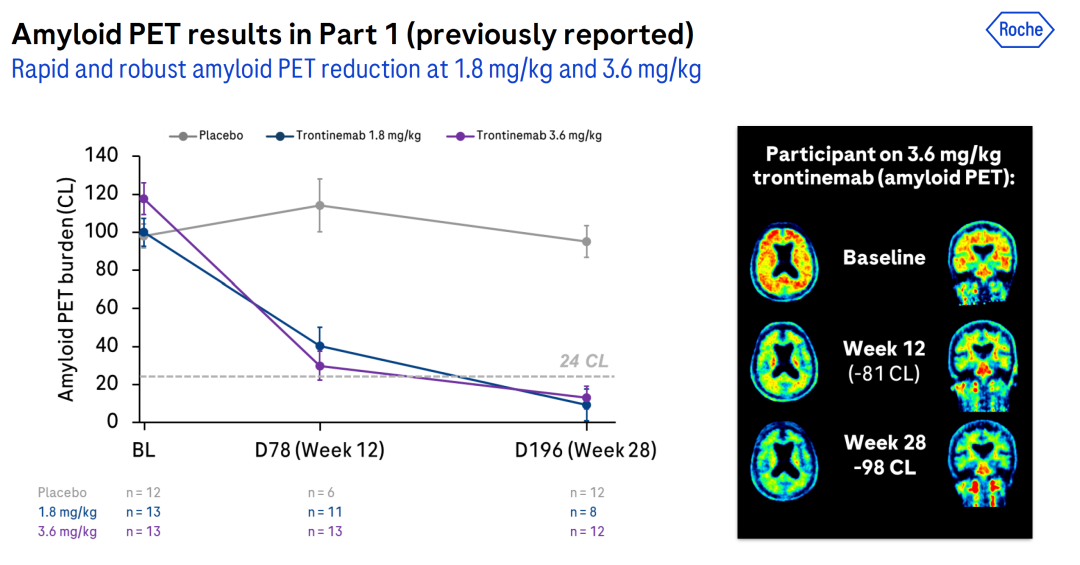
该次更新的扩展期数据显示,与1.8 mg/kg剂量相比,3.6 mg/kg剂量的trontinemab在D50 PET、D78 PET和D106 PET中显示出更优秀的淀粉样斑块清除效果。
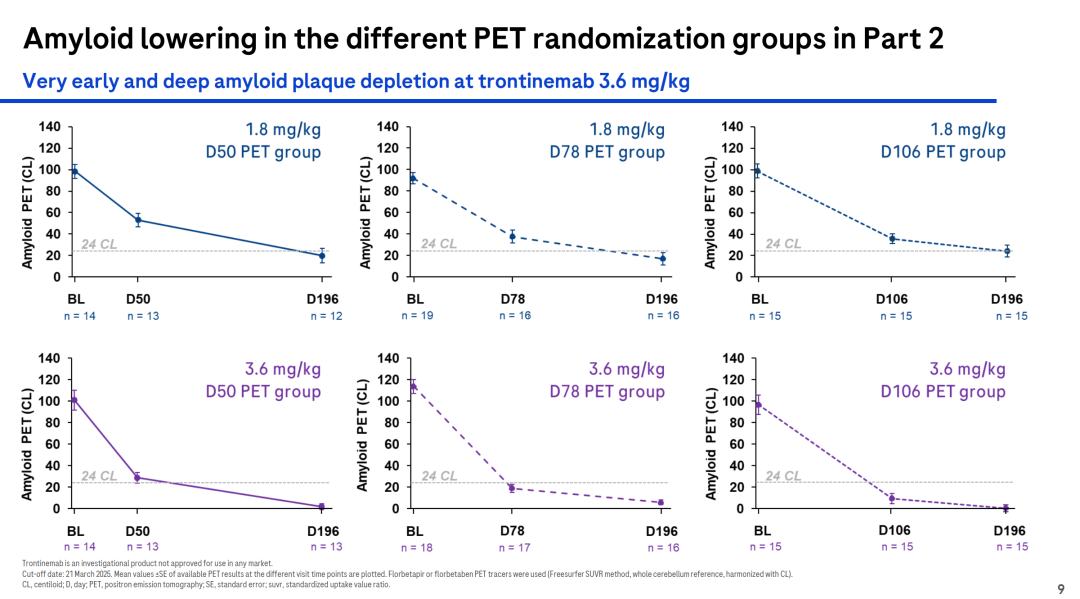
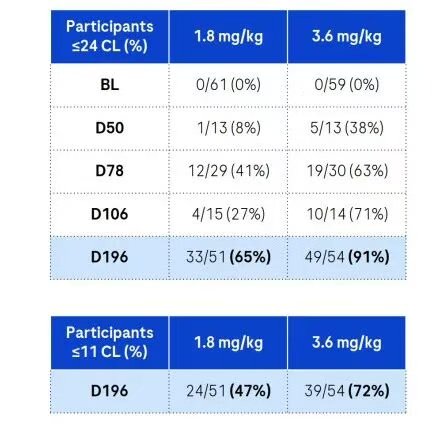
综合两个阶段的数据,3.6 mg/kg剂量的trontinemab在治疗后D196时,有91%的患者的淀粉样蛋白水平低于阳性阈值,而1.8 mg/kg剂量组在同一时间点有65%的参与者淀粉样蛋白水平低于阈值,这表明trontinemab降低AD患者脑中淀粉样蛋白的效果具有剂量依赖性。
在安全性方面,3.6 mg/kg剂量组的不良事件(SAEs)较少,且因不良事件退出研究的参与者数量也较低。在3.6 mg/kg剂量组中,有4.1%的参与者经历了严重不良事件(均与研究药物无关,且无脑部大出血)。输液相关反应(IRR)在所有剂量组中都是常见且可管理的,通常为轻度至中度,并且可以通过预处理药物进行控制,尤其是在第一次给药时。
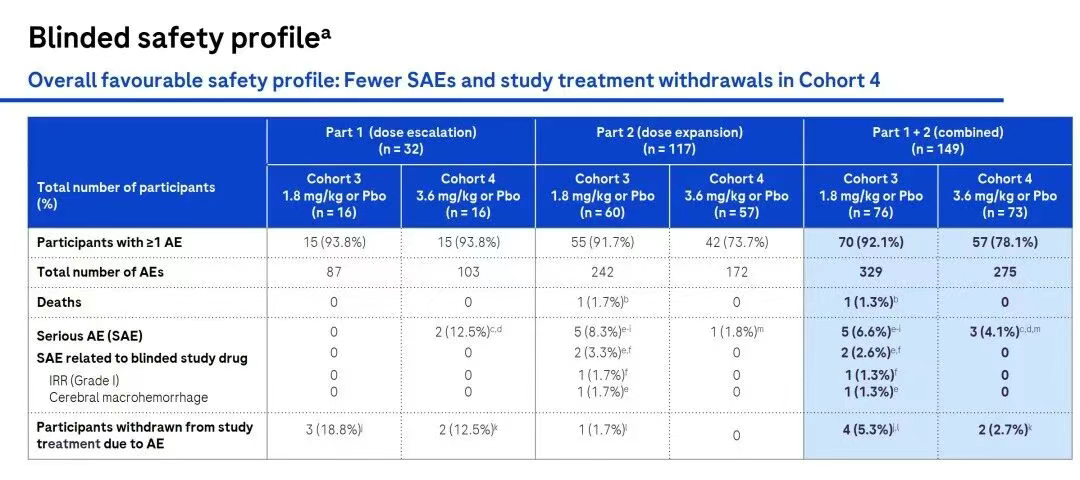
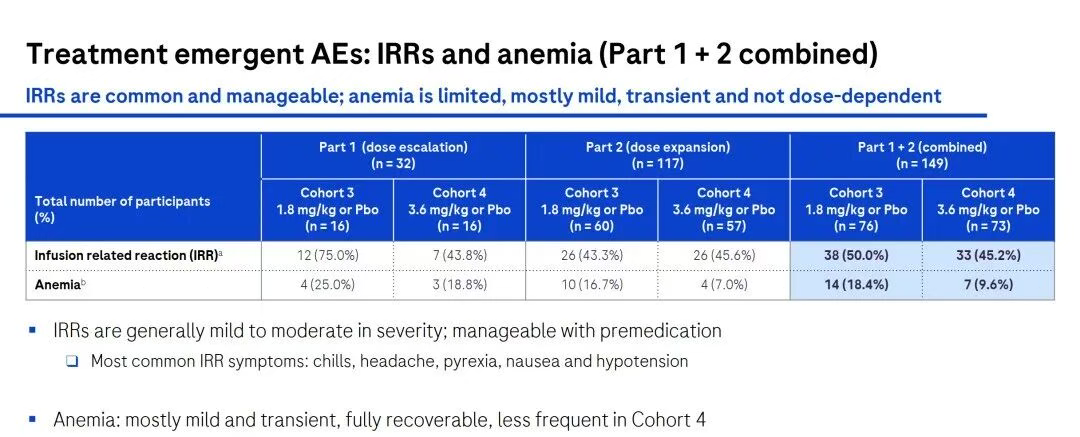
值得重点关注的是,3.6 mg/kg剂量组中,ARIA-E(淀粉样蛋白相关影像学异常-水肿/渗出)方面,总体发生率较低,仅为1.4%;ARIA-H(淀粉样蛋白相关影像学异常-微出血和铁血黄素沉积)的发生率为2.7%。这表明,trontinemab在较高剂量下具有快速且深度的淀粉样斑块清除效果,同时ARIA事件较少,显示出良好的安全性和耐受性。
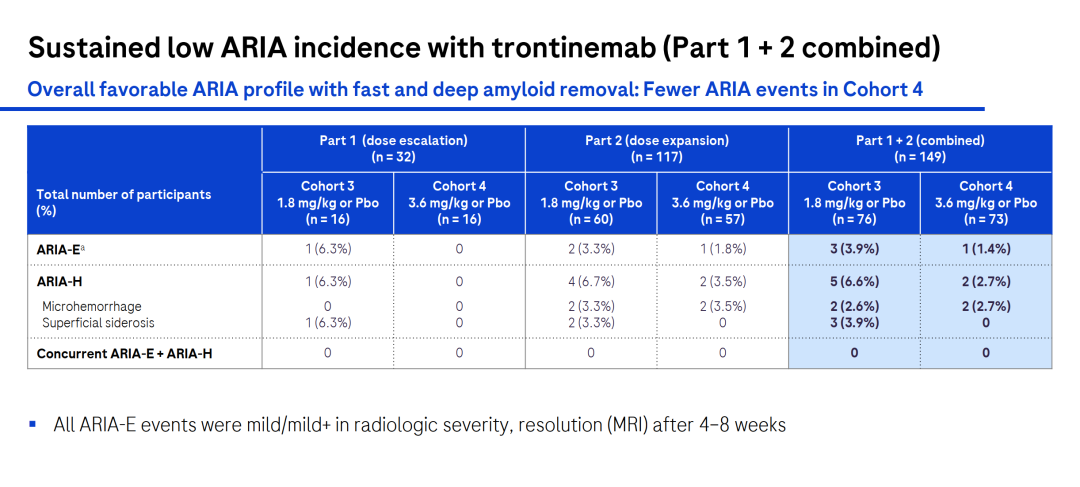
以上这些结果表明,trontinemab在较高剂量下具有快速且深度的淀粉样斑块清除效果,同时ARIA事件较少,显示出良好的安全性和耐受性。
3、Trontinemab的III期临床设计
TRONTIER 21和TRONTIER 2的受试者均为早期症状性阿尔茨海默病患者:

筛选阶段,持续时间最长为8周,诱导阶段trontinemab剂量为3.6 mg/kg Q4W,持续24周,维持期剂量为3.6 mg/kg Q12W,持续72周:
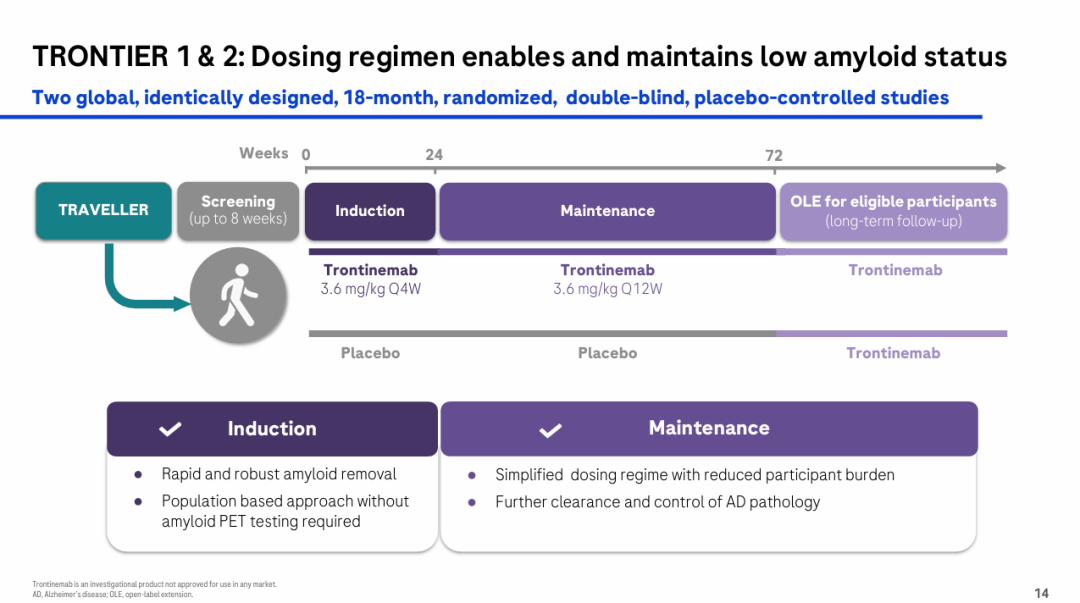
主要临床终点为临床痴呆症评分总和 (CDR-SB) 从基线到第 72 周的变化。
关键次要终点为ADAS-Cog13,用于评估认知功能; ADCS-ADL,用于评估日常生活能力;MMSE,用于评估总体认知状态;CDR-GS TTE,用于评估认知和功能的综合变化。
生物标志物:(1) Amyloid and Tau PET,用于评估大脑中的淀粉样蛋白和Tau蛋白水平。(2) CSF and plasma,用于评估脑脊液和血浆中的生物标志物。

这两项三期临床将在全球18个国家中进行试验,临床中心超过150个。
总体来看,trontinemab在早期临床阶段初步验证了其脑穿透的优势,同时安全性极为可控,未来值得期待。罗氏作为AD抗体的持续探索者,可能也将迎来突破性的转机。
文章来源:小药说药
原文链接: https://mp.weixin.qq.com/s/plilAxq1T3yTG4nYBbJujw














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论