
2025年9月11日。美国食品药品监督管理局(FDA)已授予SAR402663快速通道资格认定,该药物是一种在研的一次性玻璃体内基因疗法,用于治疗新生血管性年龄相关性黄斑变性(AMD)。
快速通道资格认定流程旨在促进治疗严重疾病和填补未满足医疗需求的药物开发并加快其审评。FDA创建此流程旨在帮助更早地将重要的新药送达患者,该流程涵盖了广泛的严重疾病。

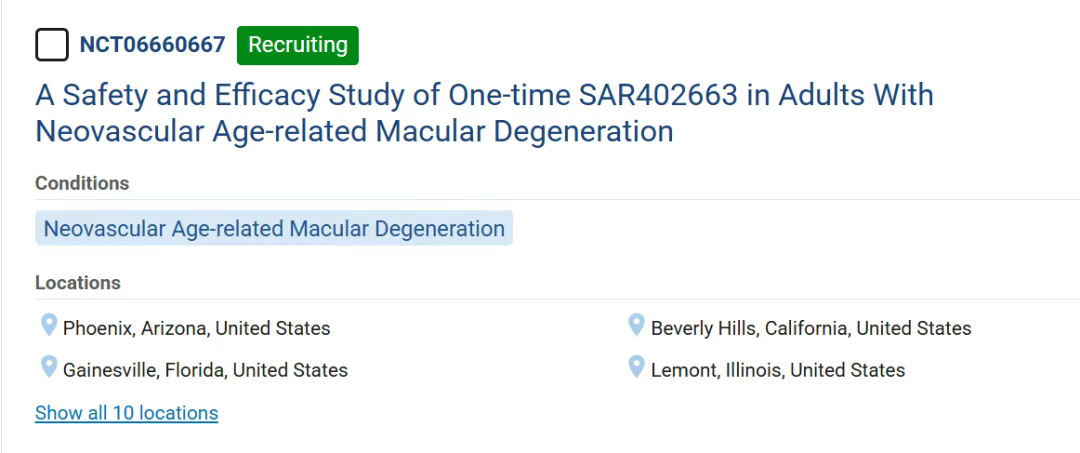
SAR402663 递送编码可溶性 FLT01 的基因物质,旨在抑制血管内皮生长因子 (VEGF)。赛诺菲目前正在对 SAR402663 进行 1/2 期临床研究评估(临床研究标识符:NCT06660667),用于治疗新生血管性AMD患者。该基因疗法旨在通过抑制异常血管生长、减少血管渗漏和最大限度地减少视网膜损伤来解决潜在的疾病病理,同时通过消除频繁的玻璃体内注射显著减轻治疗负担。
老年性黄斑变性 (AMD) 是一种获得性进行性视网膜退化疾病,全球约有 2 亿人受到影响。新生血管性 AMD 又称“湿性 AMD”是一种严重的黄斑变性。其特征是视网膜下方异常血管的生长,这可能导致视力丧失,在晚期病例中甚至可能发展为失明。新生血管性 AMD 在美国影响超过 100 万人,在全球影响 600 万人;它对生活质量,包括阅读、驾驶和其他日常活动的能力,产生深远的影响。
2025年8月4日,中国药品审评中心(CDE)公示信息显示,赛诺菲(Sanofi)SAR402663注射液治疗新生血管年龄相关性黄斑变性(nAMD)临床试验申请获默示许可。
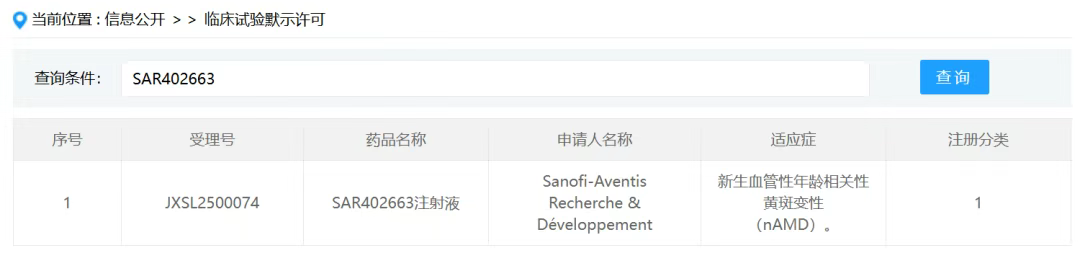
据赛诺菲官网信息,SAR402663为一次治疗的AAV-sFLT01基因疗法,计划用于nAMD,目前处于1/2期临床研究(NCT06660667)中,预计2031年6月完成。














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论