
8月26日,再生元(Regeneron Pharmaceuticals)宣布,C5 siRNA新药Cemdisiran治疗全身型重症肌无力(gMG)的三期临床BIMBLE达到主要终点和关键次要终点。再生元计划在与FDA沟通后,于2026年第一季度提交cemdisiran单药的监管申请。

分析显示,每三个月皮下注射一次的cemdisiran单药显示出平均74%的补体活性抑制率。而cemdisiran与C5抗体pozelimab的联合疗法则达成接近99%的补体活性抑制。此外,cemdisiran单药在日常生活活动量表(MG-ADL)总分(主要终点)方面,实现了相较安慰剂2.30分的改善(p=0.0005)。而联合疗法在MG-ADL总分上,则实现了相较安慰剂1.74分的改善(p=0.0086)。
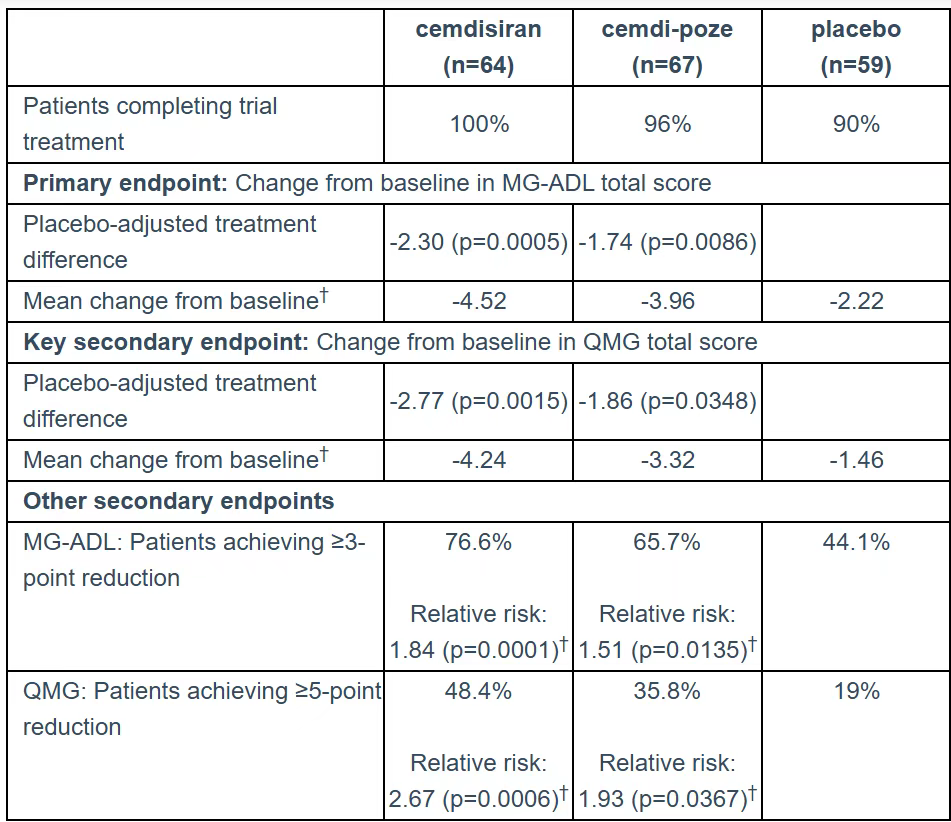
NIMBLE临床3期试验结果摘要
cemdisiran最初由 Alnylam 研发,再生元于去年修改合作协议后获得授权。根据新协议,Alnylam 收到 1000 万美元首付款,并在 cemdisiran 单药获批时有机会获得额外付款;此外,如 cemdisiran作为联合疗法上市销售,Alnylam 最高可获得 3.25 亿美元的商业里程碑付款。

Pozelimab为再生元开发的C5抗体,2023年获得FDA批准上市,用于治疗蛋白丢失性肠病(CHAPLE)。cemdisiran为一款C5靶向siRNA疗法,再生元还在探索PNH、地图样萎缩等多个适应症。
































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)













 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论