
9月23日,泽璟制药在CDE药物临床试验登记与信息公示平台网站上,登记了一项关于注射用ZG006(CD3/DLL3/DLL3)对比研究者选择的化疗在复发性小细胞肺癌患者中的有效性和安全性的多中心、随机对照、开放标签的III期临床研究。ZG006成为全球首个启动三期临床的三抗药物。
三抗药物较双抗药物增加了一个特异性抗原结合位点,因而有望诞生特异性和靶向性更强的药物,提升临床疗效并降低脱靶毒性。目前,全球尚无三抗产品获批上市,超过百款三抗产品在研,多数仍在临床前阶段,据不完全统计,十余款国产三抗处于临床阶段,适应症主要集中于肿瘤和自身免疫病。
表:处于临床阶段的国产三抗药物
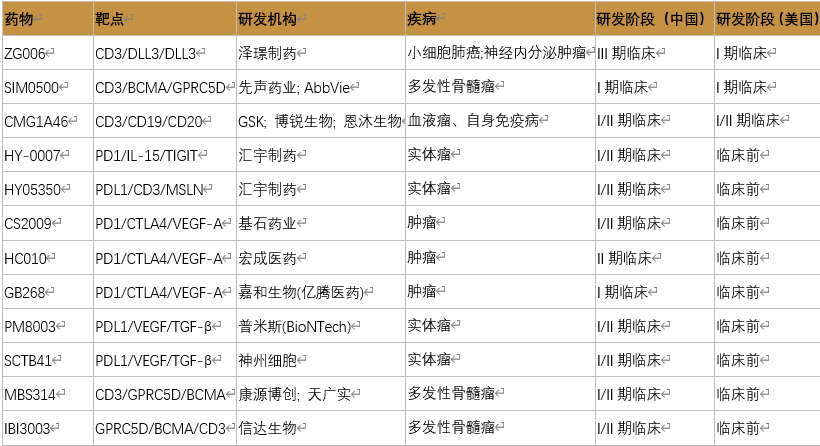
数据来源:公开资料整理
随着双抗药物的持续火热,三抗产品陆续受到海外企业的青睐,多款三抗产品成功出海,涉及的企业包括先声药业、维立志博、恩沐生物等。未来,随着三抗药物数据的持续读出,更多国产三抗药物有望授权出海。
表:成功出海的国产三抗药物
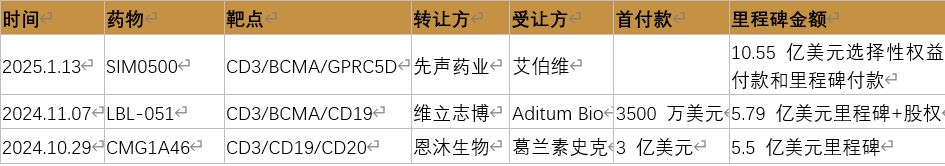
数据来源:公开资料整理
凭借三抗药物的大红大紫,部分创新药企业股价水涨船高。回首4-5年前,双抗龙头康方生物的股价不足100亿港元,而目前股价早已突破1000亿港元大关,正是凭借AK104和AK112两款双抗药物的贡献。未来,三抗企业能否复制康方生物的神话,让我们拭目以待。
(一)泽璟制药:ZG006(CD3/DLL3/DLL3)
ZG006为泽璟制药开发的CD3/DLL3/DLL3三抗药物,结合两个不同表位的DLL3,通过靶向DLL3和CD3将肿瘤细胞和T细胞结合,用于T细胞介导的肿瘤细胞杀伤,对于DLL3不同表达量的肿瘤细胞均有较好的杀伤效果。ZG006正在开发的适应症包括小细胞肺癌和神经内分泌癌,ZG006目前处于临床Ⅲ期。
图:ZG006分子结构
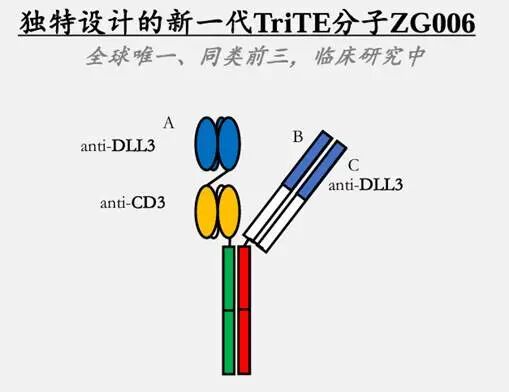
数据来源:泽璟制药宣传资料
在2025CSCO年会上,泽璟制药更新了ZG006单药治疗在难治性晚期小细胞肺癌患者中的II期剂量优化临床研究(ZG006-002),共60例三线及以上小细胞肺癌(SCLC)患者按1:1随机接受ZG006 10 mg Q2W或30 mg Q2W治疗并纳入分析。10 mg Q2W组(30例)和30 mg Q2W组(30例)最佳缓解率(ORR)分别为60.0%和63.3%,确认的缓解率均为53.3%,疾病控制率(DCR) 分别为 73.3% 和70.0%,3 个月 DoR 率分别为 91.7% 和 66.7%。安全性方面,两组的整体耐受性和安全性均良好,未发生任何因治疗期不良事件(TEAE)导致的永久停药。
图:ZG006作用机制
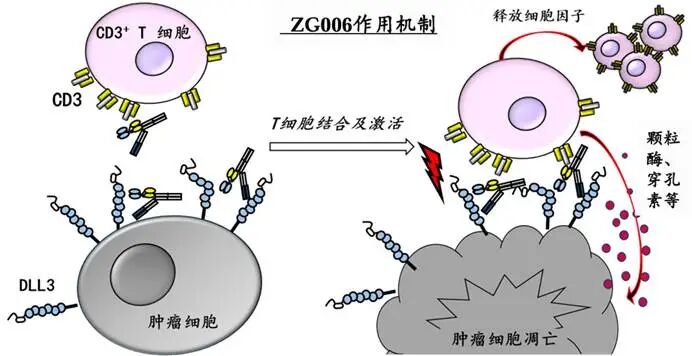
数据来源:泽璟制药宣传资料
(二) 基石药业:CS2009(PD-1/VEGF/CTLA-4)
CS2009是基石药业旗下一款PD-1/VEGF/CTLA-4三特异性抗体,目前处于临床Ⅱ期。近年来,PD-1/VEGF双抗持续授权出海,从康方生物的AK112至三生药业的SSGJ-707,前者总交易金额高达50亿美金,后者更是超过60亿美金。究其原因,在于PD-1/VEGF双抗有望成为替代PD-1的免疫基石药物,鉴于K药每年销售额超过300亿美金,若双抗能替代PD-1单抗,有望瓜分PD-1的巨大市场。
基于此,基石药业的CS2009应运而生,CS2009具备差异化的分子设计,结合了三个经临床验证的靶点,能够重新启动接近耗竭状态的肿瘤浸润T细胞,并具备与原抗VEGF抗体相当的VEGF中和能力。7月,基石药业公告称,CS2009第四剂量水平(20毫克/千克,每三周给药一次)经安全性监测委员会(SMC)评估未发生剂量限制性毒性(DLT)。9月,基石药业宣布CS2009的II期临床试验于澳大利亚完成首例患者入组。
图:CS2009分子设计及临床前数据
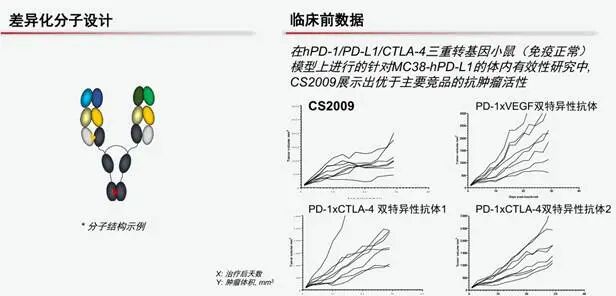
数据来源:基石药业宣传资料
(三) 先声药业:SIM0500(GPRC5D/BCMA/CD3)
先声药业的SIM0500是一种靶向GPRC5D/BCMA/CD3的人源化三特异性抗体,目前处于临床Ⅰ期。2025年1月,先声药业与艾伯维(AbbVie)宣布就SIM0500达成许可选择协议,根据该协议条款,先声再明从艾伯维收取首付款,以及最高10.55亿美金的选择性权益付款和里程碑付款。
SIM0500的一个强有力的竞争者为强生的JNJ-5322(GPRC5D/BCMA/CD3)。
在今年ASCO上,强生披露了JNJ-5322的Ⅰ期研究结果,126例既往接受过4线治疗的患者的ORR为73%,VGPR=66%,其中36例RP2D剂量组(n=36)的ORR为86%,VGPR=75%,。在未接受过抗BCMA/GPRC5D治疗的27名患者中,RP2D剂量组的ORR达100%,VGPR=89%。JNJ-5322的疗效数据十分优异,但鉴于5例患者出现剂量限制性毒性,4例患者因AE死亡,JNJ-5322的安全性问题成为隐忧。
图:SIM0500在BCMA高/低表达的模型中均展现出良好的效果
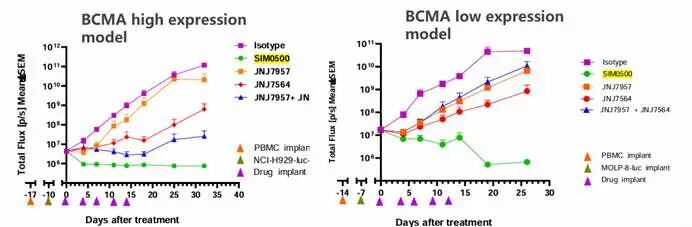
数据来源:先声药业宣传资料
(四) 汇宇制药:HY-0007(PD-1/TIGIT/IL-15)
HY-0007是汇宇制药自主研发的抗PD-1、抗TIGIT、IL-15/IL-15Rα双抗融合蛋白,目前处于临床Ⅰ期。
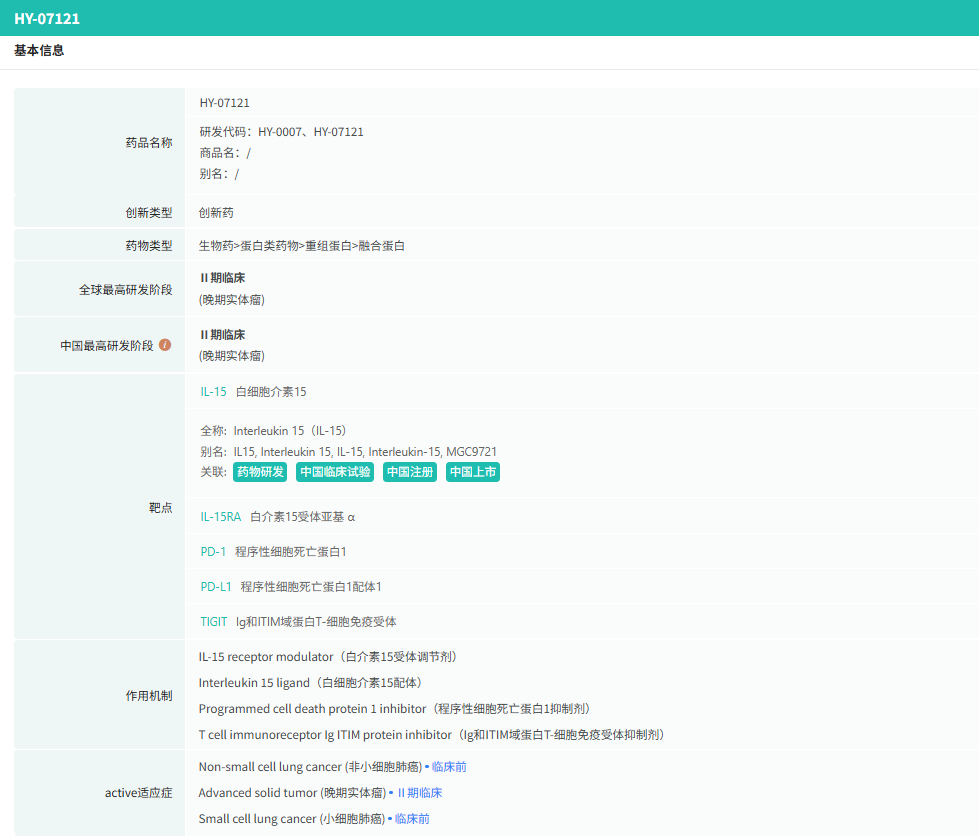
截图来源:摩熵医药数据库(全球药物研发数据库)
HY-0007的竞争优势主要包括以下4点:
(1)同时靶向PD-1、IL-15和TIGIT三个靶点,具有独特的作用机制和协同效应;
(2)能够部分克服PD-1抗体治疗后出现的获得性耐药问题,为耐药患者提供新的治疗选择;
(3)通过IL-15/IL-15Rα融合蛋白不仅可以补充免疫细胞来源,还可以增强免疫细胞功能,提高抗肿瘤效果;
(4)通过特殊的空间位阻结构设计,并结合双免疫检查点的导向性作用,减弱细胞因子的系统毒性,在食蟹猴研究中显示出良好的安全性。
(五) 小结
三抗的时代已经来临,ZG006已率先进入临床Ⅲ期,标志着三抗药物距离商业化大幅迈进一步。近年来,多款三抗药物成功授权,相关企业包括先声药业、维立志博、恩沐生物等。泽璟制药、基石药业、汇宇制药、信达生物、神州细胞等企业的三抗药物正在加速推进临床中,期待未来优异的临床数据,并成功授权出海。
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论