1.4.1本周全球TOP10创新药研发进展
(1)来恩生物TCR-T疗法治疗乙肝在美国获批IND
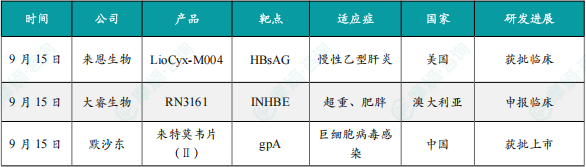
9月15日,来恩生物(Lion TCR)宣布其创新mRNA编码TCR-T细胞疗法产品LioCyx-M004获得美国FDA批准,开展治疗慢性乙型肝炎(CHB)的1b/2期临床试验(IND)。该疗法此前已获得FDA批准IND,用于治疗乙肝病毒相关肝细胞癌。
LioCyx-M004是一种自体T细胞疗法,通过mRNA编码表达靶向乙肝病毒表面抗原的TCR,赋予T细胞特异性识别并杀伤乙肝病毒感染肝细胞的能力。这种创新方法利用mRNA瞬时表达的特性,结合多次输注的方式,既能很好地控制安全性又能保证疗效。该产品通过精准靶向HBV感染细胞、激活病毒特异性T细胞免疫,有望为乙肝患者带来实现功能性治愈的新疗法。在早期的1期临床研究中,LioCyx-M004已展现了良好的安全性,使晚期肝癌患者生存期得到显著提升,实现了33.1个月的中位总生存期,并观察到乙肝表面抗原(HBsAg)的下降,显示出抗肿瘤和抗病毒治疗效果。
(2)大睿生物siRNA新药澳洲临床试验申请获受理
9月15日,大睿生物(Rona Therapeutics)宣布,该公司自主研发的RN3161已向澳大利亚人类研究伦理委员会(HREC)递交临床试验申请。
RN3161是一款靶向INHBE的GalNAc-siRNA,旨在为超重及肥胖人群提供可长期维持的减重疗法。INHBE已成为改善肥胖治疗的高潜力靶点。研究发现,INHBE基因主要在肝脏中表达,编码的Activin E蛋白可调控脂肪代谢。部分人群若携带INHBE特定基因变异,往往呈现更健康的脂肪分布和体成分、更理想的血脂水平,并显著降低2型糖尿病及心血管疾病风险。RN3161能够通过精准沉默INHBE减少脂肪、同时保持瘦体重,从而区别于现有减重治疗方式。该产品优化的GalNAc递送设计与化学修饰组合降低了脱靶风险。在临床前研究中,低剂量单次给药后即观察到INHBE mRNA表达下调超过90%,在效力与持久性上也表现良好。临床前研究显示,RN3161可实现超过半年的基因沉默效应,有望将给药频率降低至每年仅1–2次,显著提升患者依从性和长期管理潜力。
(3)默沙东来特莫韦片(Ⅱ)在华获批上市
9月15日,默沙东宣布其新型非核苷类巨细胞病毒(CMV)抑制剂来特莫韦(商品名:普瑞明)的全新剂型——来特莫韦片(Ⅱ)在中国获批上市,用于接受异基因造血干细胞移植(HSCT)的巨细胞病毒(CMV)血清学阳性的成人和6个月及以上且体重≥6kg的儿童受者[R+]预防巨细胞病毒感染和巨细胞病毒病。
来特莫韦是国内首个且目前唯一可用于接受HSCT成人和儿童患者的CMV预防方案。来特莫韦片(Ⅱ)包含 20mg/袋和120mg/袋两种规格,满足了来特莫韦适应症内覆盖的各年龄和体重患者的剂量需求,此前,来特莫韦已在中国获批来特莫韦片与来特莫韦注射液两种剂型。
(4)康方生物癌症新药注射用AK138D1在中国获批临床
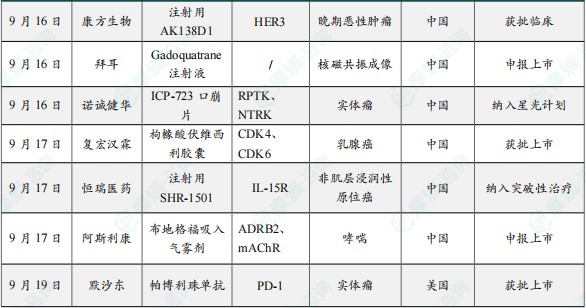
9月16日,中国国家药监局药品审评中心(CDE)官网公示,康方生物申报的1类新药注射用AK138D1获批临床试验默示许可,拟开发治疗晚期恶性肿瘤。公开资料显示,这是康方生物研发的差异化靶向人表皮生长因子受体3(HER3)的抗体偶联药物(ADC),也是该公司首个进入临床阶段的ADC药物。今年2月,该产品治疗晚期恶性肿瘤的1期临床研究在澳洲完成首例受试者入组。
根据康方生物公开资料介绍,注射用AK138D1是靶向HER3的ADC,抗体部分为全人源化抗HER3 IgG1抗体Patritumab,通过可裂解的连接子MC-AAA(马来酰亚胺-丙氨酸-丙氨酸-丙氨酸)与拓扑异构酶Ⅰ抑制剂DXd偶联而成。注射用AK138D1与肿瘤细胞上的HER3结合后,ADC经过内化进入肿瘤细胞,随后其连接子被裂解并释放具有膜通透性的DXd,进而导致DNA损伤和细胞凋亡。目前康方生物在澳洲开展针对AK138D1在晚期恶性肿瘤治疗中的安全性、耐受性、药代动力学和初步疗效的剂量递增和扩展的1期临床研究已完成患者入组。
(5)拜耳1类新药Gadoquatrane注射液国内首次申报上市
9月16日,CDE官网显示,拜耳1类新药Gadoquatrane注射液在国内申报上市。根据该药的临床研究进度,推测本次申报适应症为用于核磁共振成像。Gadoquatrane是拜耳开发的一种处于临床阶段的细胞外大环造影剂,用于增强MRI的对比度。这种低剂量钆基造影剂具有独特的四聚体结构,具有高稳定性和高弛豫率。
今年6月和7月,拜耳已先后在日本、美国、欧盟递交了Gadoquatrane的上市申请,用于成人和儿科患者(包括新生儿)中枢神经系统(CNS)及其他身体部位的增强磁共振成像。拜耳新闻稿指出,一旦获批,Gadoquatrane将成为美国和欧盟市场上剂量最低的大环钆造影剂 (GBCA)。
(6)诺诚健华抗肿瘤1类新药被CDE纳入星光计划
9 月 16日,CDE官网公示,依据《儿童抗肿瘤药物研发鼓励试点计划(星光计划)申报指南》,将诺诚健华的ICP-723口崩片纳入星光计划,拟开发儿童适应症:携带神经营养酪氨酸受体激酶(NTRK)融合基因的实体瘤。
卓乐替尼(ICP-723)是一款新一代泛TRK抑制剂。今年4月,该药已在国内递交了首个新药上市申请,用于治疗携带NTRK融合基因的晚期实体瘤成人和青少年(12 周岁≤年龄<18 周岁)患者,该申请已被纳入优先审评。星光计划是CDE组织制定并于今年5月发布正式实施,旨在就抗肿瘤药物儿童人群研究过程中技术难点提供针对性指导,提高儿童抗肿瘤药物的研发效率,迄今为止,共有两款药物被纳入星光计划。
(7)复宏汉霖CDK4/6抑制剂枸橼酸伏维西利胶囊在中国获批新适应症
9月17日,复宏汉霖宣布,创新型CDK4/6抑制剂枸橼酸伏维西利胶囊新增适应症的药品注册申请获得中国国家药品监督管理局(NMPA) 批准。本次获批适应症为用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性(HR+/HER2-)局部晚期或转移性乳腺癌成人患者:与芳香化酶抑制剂联合使用作为初始内分泌治疗。此前,枸橼酸伏维西利胶囊已获批联合氟维司群用于既往接受内分泌治疗后出现疾病进展的HR+/HER2-的复发或转移性乳腺癌。
枸橼酸伏维西利胶囊为复星医药子公司奥鸿药业开发的创新型小分子CDK4/6抑制剂,是一种口服、强效、高选择性、全新结构的创新小分子药物。研究表明,该新药能够显著延长患者中位无进展生存期,降低疾病进展的风险,整体安全性可控。该产品在中国的商业化推广由复宏汉霖负责。
(8)恒瑞医药1类新药注射用SHR-1501拟纳入突破性治疗品种
9月17日,中国国家药监局药品审评中心(CDE)官网公示,恒瑞医药申报的1类新药注射用SHR-1501拟纳入突破性治疗品种,拟定适应症为:SHR-1501联合卡介苗(BCG)用于BCG无应答的非肌层浸润性原位癌(CIS)患者。公开资料显示,这是恒瑞医药研发的一款白细胞介素-15(IL-15)融合蛋白。IL-15通过影响自然杀伤(NK)细胞和免疫T细胞的发育、维持和功能,在免疫系统中发挥着至关重要的作用。IL-15激动剂可通过刺激自然杀伤细胞和CD8+ cytotoxic T细胞的增殖与活化(且不诱导调节性T细胞)来增强BCG诱导的免疫反应。
SHR-1501是一种IL-15激动剂融合蛋白,由人源化抗体Fc区与IL-15及IL-15Rα sushi结构域融合构成。SHR-1501可以刺激体内T细胞、B细胞和NK细胞增殖,发挥调动机体免疫系统清除体内异物(如肿瘤)的作用。与IL-2相比,IL-15不会刺激Treg增殖和诱导T细胞凋亡。
(9)阿斯利康哮喘三联疗法布地格福吸入气雾剂在华申报上市
9月17日,CDE网站显示,阿斯利康的布地格福吸入气雾剂(英文商品名:Breztri®,中文商品名:倍泽瑞®令畅®)在华申报新适应症。根据临床试验进展,推测此次申报的适应症为哮喘。
布地格福吸入气雾剂是阿斯利康开发的一款固定剂量三联疗法,包含布地奈德(吸入糖皮质激素)、格隆溴铵(长效毒蕈碱型乙酰胆碱受体拮抗剂)、福莫特罗(长效β2肾上腺素受体激动剂)三种药物活性成分。2019年6月,该产品首次在日本获批上市,用于维持治疗慢性阻塞性肺病(COPD)。同年12月,该产品在中国获批上市。
(10)默沙东帕博利珠单抗皮下注射剂型在美国获批上市
9月19日,默沙东宣布帕博利珠单抗皮下注射注射制剂(MK-3475A,商品名:Keytruda Qlex)获得FDA批准上市。该制剂可以每3周注射1次(1分钟内完成给药),也可以每6周注射1次(2分钟内完成给药),比需要静脉输注30分钟完成给药的静脉注射制剂更节省时间且便利,并且还可以选择大腿或腹部注射,避开肚脐周围5厘米的区域。
2024年11月,默沙东宣布关键性III期MK-3475A-D77研究取得了积极结果。该研究是一项随机、开放标签临床试验(n=378),评估了帕博利珠单抗皮下注射制剂联合化疗对比帕博利珠单抗静脉注射制剂联合化疗一线治疗转移性非小细胞肺癌(NSCLC)成人患者的药代动力学(PK)、疗效和安全性。结果显示,该研究达到了其双重主要终点。
1.4.2本周全球TOP10积极/失败临床结果
(1)Revolution Medicines公司公布daraxonrasib 1期临床试验最新数据
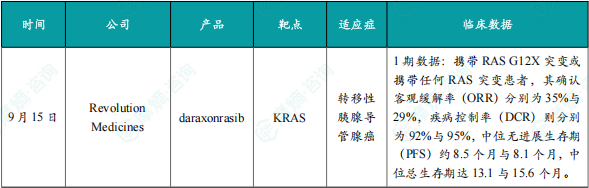
9月15日,Revolution Medicines公司宣布了其RAS(ON)多重选择性抑制剂daraxonrasib(RMC-6236)的1期临床试验的最新进展。
Daraxonrasib是一款口服选择性抑制剂,能够靶向处于GTP结合(激活、ON)状态的突变型及野生型RAS蛋白。该疗法曾在2025年6月获美国FDA授予突破性疗法认定,用于治疗既往接受治疗、携带KRAS G12突变的转移性胰腺导管腺癌(PDAC)患者。
此次公布的结果显示,在二线及以上(2L+)转移性PDAC患者中,接受每日一次(QD)300 mg daraxonrasib治疗的患者表现出良好的耐受性,安全性与既往数据一致。疗效方面,携带RAS G12X突变或携带任何RAS突变患者,其确认客观缓解率(ORR)分别为35%与29%,疾病控制率(DCR)则分别为92%与95%,中位无进展生存期(PFS)约8.5个月与8.1个月,中位总生存期(OS)达13.1与15.6个月。
(2)PMV Pharmaceutica公司公布rezatapopt 1/2期临床试验数据
9月15日,PMV Pharmaceuticals公司公布了其PYNNACLE关键性临床1/2期试验中,2期部分的中期数据。该试验旨在评估rezatapopt(PC14586)在携带TP53 Y220C突变的晚期实体瘤患者中的疗效。Rezatapopt是一款潜在“first-in-class”的小分子p53再激活剂,能够选择性结合p53 Y220C突变蛋白的特定口袋,从而恢复其野生型抑癌功能。
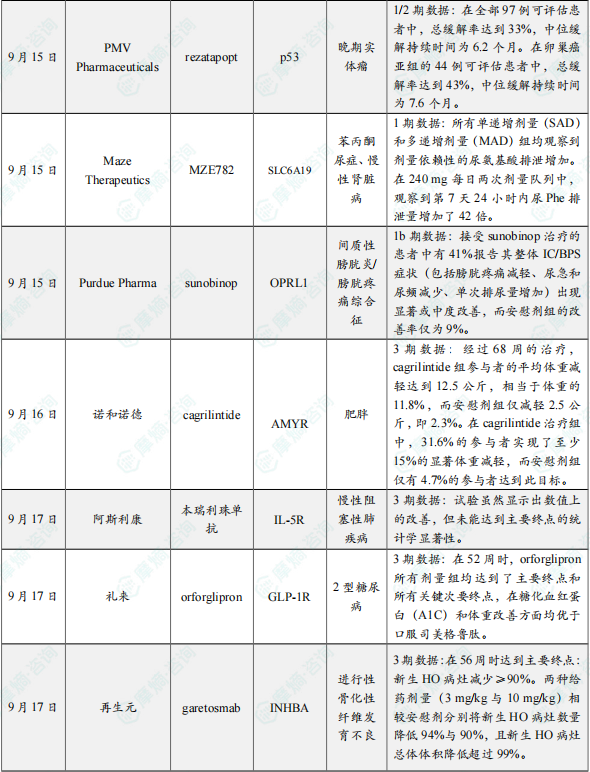
中期结果显示,该药物在卵巢癌、肺癌、乳腺癌、子宫内膜癌、头颈癌、结直肠癌、胆囊癌及壶腹癌等八种肿瘤类型中均观察到确认的治疗应答。在全部97例可评估患者中,总缓解率达到33%,中位缓解持续时间为6.2个月。在卵巢癌亚组的44例可评估患者中,总缓解率达到43%,中位缓解持续时间为7.6个月。基于这些积极结果,公司计划于2027年第一季度提交rezatapopt用于治疗铂类耐药或复发性卵巢癌的新药申请(NDA)。
(3)Maze Therapeutics公司公布MZE782 1期临床积极结果
9月15日,Maze Therapeutics公司宣布,其口服小分子药物MZE782在针对健康受试者的1期临床试验中取得积极结果。MZE782是一种靶向溶质转运蛋白SLC6A19的口服小分子,具备成为苯丙酮尿症(PKU)“best-in-class”疗法,以及慢性肾脏病(CKD)“first-in-class”疗法的潜力。该药物通过抑制SLC6A19蛋白功能,减少苯丙氨酸(Phe)从肠道的吸收和在肾脏的重吸收,从而能降低血浆Phe水平,有望为PKU患者提供一种不受基因型限制的新疗法。对于CKD,MZE782通过减轻SLC6A19介导的重吸收引起的肾近端小管的超负荷代谢,有望延缓疾病进展,其机制与SGLT2抑制剂不同且可以互补。
此次公布的结果显示,所有单递增剂量(SAD)和多递增剂量(MAD)组均观察到剂量依赖性的尿氨基酸排泄增加。在240 mg每日两次剂量队列中,观察到第7天24小时内尿Phe排泄量增加了42倍。该指标是经过充分验证的PKU生物标志物,且对CKD具有预测价值。MZE782还表现出与SGLT2抑制剂类似的剂量依赖性初始估算肾小球滤过率(eGFR)下降,提示其可能具有肾脏保护作用。此外,该药物的安全性和耐受性良好,未报告严重不良事件。
(4)Purdue Pharma公司公布sunobinop临床1b期初步积极结果
Purdue Pharma公司宣布,其针对间质性膀胱炎/膀胱疼痛综合征(IC/BPS)的在研新药sunobinop的1b期临床研究取得了积极的初步结果。IC/BPS是一种慢性、痛苦的泌尿系统疾病,严重影响患者的生活质量。Sunobinop是一种潜在“first-in-class”的口服化合物,旨在结合并激活广泛存在于中枢和外周神经系统中的伤害感受素/孤啡肽FQ肽受体(NOP),该受体参与多种生理功能调节。
此次公布的结果显示,在双盲治疗期结束时,接受sunobinop治疗的患者中有41%报告其整体IC/BPS症状(包括膀胱疼痛减轻、尿急和尿频减少、单次排尿量增加)出现显著或中度改善,而安慰剂组的改善率仅为9%。安全性方面,没有死亡、严重不良事件或因不良事件而停用sunobinop的报告。研究中观察到的最常见的不良事件是尿路感染和嗜睡。
(5)诺和诺德公布cagrilintide临床3期减肥结果
9月16日,诺和诺德公布了其新一代胰淀素(amylin)类似物cagrilintide的3期REDEFINE 1试验的亚组分析数据,结果显示该药物在体重减轻方面取得了显著且具有临床意义的结果。此次公布的REDIEFINE 1亚组分析数据聚焦于每周一次2.4毫克cagrilintide单药疗法结合生活方式干预,针对患有肥胖症或超重并伴有体重相关合并症(不含糖尿病)的成年人。经过68周的治疗,cagrilintide组参与者的平均体重减轻达到12.5公斤,相当于体重的11.8%,而安慰剂组仅减轻2.5公斤,即2.3%。在cagrilintide治疗组中,31.6%的参与者实现了至少15%的显著体重减轻,而安慰剂组仅有4.7%的参与者达到此目标。
(6)阿斯利康首创IL-5Rα单抗本瑞利珠单抗3期COPD研究未达主要终点
9月17日,阿斯利康宣布,其Fasenra(本瑞利珠单抗)治疗慢性阻塞性肺疾病(COPD)的III期RESOLUTE试验虽然显示出数值上的改善,但未能达到主要终点的统计学显著性。该试验中本瑞利珠单抗的安全性与耐受性特征与已知特性一致。公司将对RESOLUTE试验的完整数据集进行深入分析以进一步理解结果,未来将与科学界分享相关发现。
本瑞利珠单抗是阿斯利康开发的一款首创IL-5Rα单抗,目前已在美国、日本、欧盟和中国等80多个国家获批作为重度嗜酸性粒细胞性哮喘(SEA)的附加维持治疗,并在美国和日本获批用于6岁及以上儿童及青少年的SEA治疗。该药物还在60多个国家获批用于治疗成人嗜酸性肉芽肿性多血管炎(EGPA),目前针对高嗜酸性粒细胞综合征(HES)的适应症正在接受监管审评。
(7)礼来口服GLP-1RA orforglipron在3期头对头研究中优于口服司美格鲁肽
9月17日,礼来公布了ACHIEVE-3研究的积极顶线结果,该研究是一项开放标签、随机的3期临床研究,在1698名经二甲双胍治疗血糖控制不佳的2型糖尿病成人参与者中,评估了orforglipron对比口服司美格鲁肽(按照已获批说明书用药)的安全性和有效性。该研究为期52周,在四个活性治疗组中对比了orforglipron(12mg和36mg)与口服司美格鲁肽(7mg和14mg)在血糖控制和体重减轻方面的结果。在52周时,orforglipron所有剂量组均达到了主要终点和所有关键次要终点,在糖化血红蛋白(A1C)和体重改善方面均优于口服司美格鲁肽。
(8)再生元在研疗法garetosmab 3期研究达主要终点
9月17日,再生元宣布,其在研疗法garetosmab用于治疗成人进行性骨化性纤维发育不良(FOP)的3期OPTIMA研究达到主要终点。该疗法能够显著减少新生异位骨化(HO)病灶的数量与体积。公司计划于2025年年底前向美国FDA提交相关监管申请。根据新闻稿,garetosmab为在成人FOP人群中同时显著降低HO病灶数量与体积的首个治疗方案。
Garetosmab是一款靶向Activin A的单克隆抗体,研究结果显示,在56周时达到主要终点:新生HO病灶减少≥90%。两种给药剂量(3 mg/kg与10 mg/kg)相较安慰剂分别将新生HO病灶数量降低94%与90%,且新生HO病灶总体体积降低超过99%。基于上述疗效与安全性结果,独立数据监测委员会(IDMC)建议安慰剂组患者尽快转入garetosmab治疗。
(9)强生口服IL-23药物icotrokinra在3期头对头研究中优于氘可来昔替尼
9月17日,强生公布了III期ICONIC-ADVANCE 1和ICONIC-ADVANCE 2研究的最新数据,这两项研究评估了icotrokinra与安慰剂和氘可来昔替尼相比,治疗中重度斑块状银屑病患者的疗效与安全性。这些数据将在2025年欧洲皮肤病与性病学会(EADV)大会上公布。
Icotrokinra是一种first-in-class的IL-23受体靶向口服肽,ICONIC-ADVANCE 1和2研究的关键研究结果显示:icotrokinra在第16周达到两个共同主要终点(IGA 0/1和PASI 90),显示出相比安慰剂的显著优效性;在第16周和第24周,icotrokinra显示出优于氘可来昔替尼(deucravacitinib)的皮肤清除效果。icotrokinra的不良事件发生率与安慰剂相似,未发现新的安全信号,且数值上低于氘可来昔替尼。
(10)阿斯利康皮下注射首创生物制剂Saphnelo 3期研究成功,治疗红斑狼疮
9月17日,阿斯利康宣布,其皮下注射首创生物制剂Saphnelo(Anifrolumab,阿尼鲁单抗皮下注射剂)针对系统性红斑狼疮(SLE)患者3期TULIP-SC试验的预定中期分析达到主要终点。TULIP-SC是一项3期、多中心、跨国、随机、双盲、安慰剂对照研究,旨在评估在接受标准护理(SOC)治疗的中度至重度活动性自身抗体阳性SLE患者中,皮下注射Saphnelo与安慰剂的疗效和安全性。结果显示,与安慰剂相比Saphnelo皮下注射(SC)疗法显著降低了疾病活动度,且具有临床意义。中期分析中观察到的安全性与Saphnelo静脉(IV)输注的已知临床特征一致。具体的研究数据将于2025年10月24日至29日在美国风湿病学会(ACR) Convergence 2025年会上公布。
同期事件:
1. 2025年第38周09.15-09.21国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第38周09.15-09.21国内仿制药/生物类似物申报/审批数据分析
3. 2025年第38周09.15-09.21国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.15-2025.09.21) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论