1.1.1 总体概况
根据摩熵医药数据库统计,2025.09.08-2025.09.14期间共有92个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号62个,进口药品受理号30个。
本周共计41款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药22款,生物药18款,中药1款。其中值得注意的有:
(1)乙磺酸LY-4066434片
9月8日,CDE官网公示:礼来的乙磺酸LY-4066434片获得临床试验默示许可,拟用于携带KRAS突变的晚期或转移性实体瘤患者的治疗。公开资料显示,乙磺酸LY-4066434片是一种口服小分子泛KRAS抑制剂,对HRAS和NRAS具有高选择性,在KRAS突变模型(包括中枢神经系统)中显示出强大的抗肿瘤活性。
(2)GR2303注射液
9月10日,CDE官网公示:智翔金泰申报的GR2303注射液获得临床试验默示许可,拟用于治疗系统性红斑狼疮。公开资料显示,GR2303注射液是智翔金泰自主研发的重组全人源抗肿瘤坏死因子样配体1A(TL1A)单克隆抗体,本品可通过靶向结合TL1A,阻断TL1A与死亡受体3(DR3)的结合,进而抑制TL1A引起的下游通路信号传导,减少促炎因子(如TNF-α、IL-17、IFN-γ)的释放,达到治疗炎症性肠病的效果。
(3)ALK2401片
9月12日,CDE官网公示:艾立康申报的1类新药ALK-2401片获得临床试验默示许可,拟用于治疗周围神经病理性疼痛。公开资料显示,这是一种非阿片类、非中枢作用机制的选择性小分子口服抑制剂。
本周无新药获批上市。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
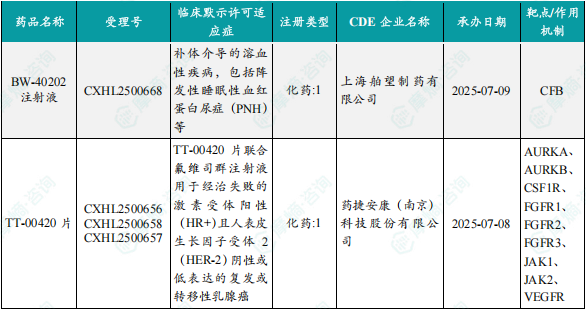
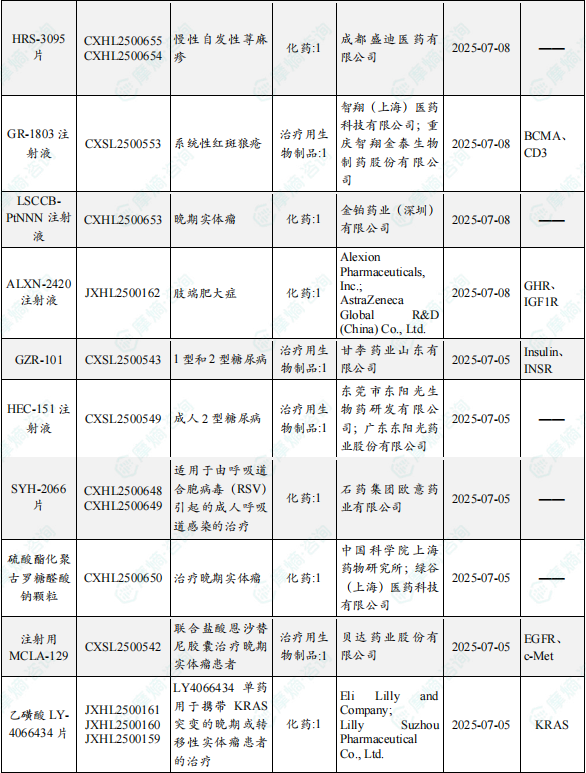
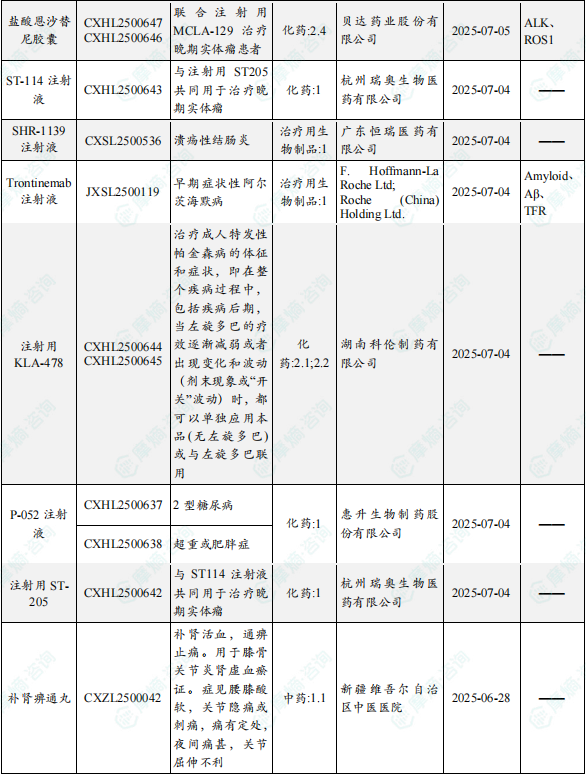
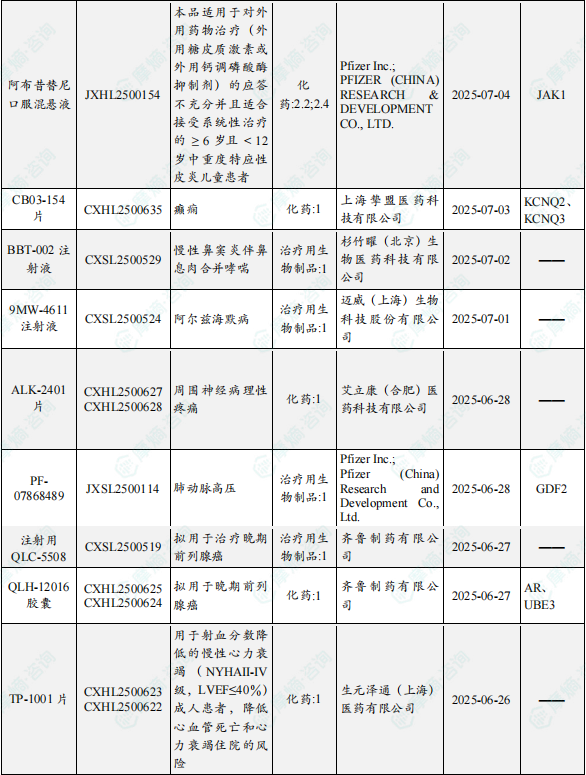
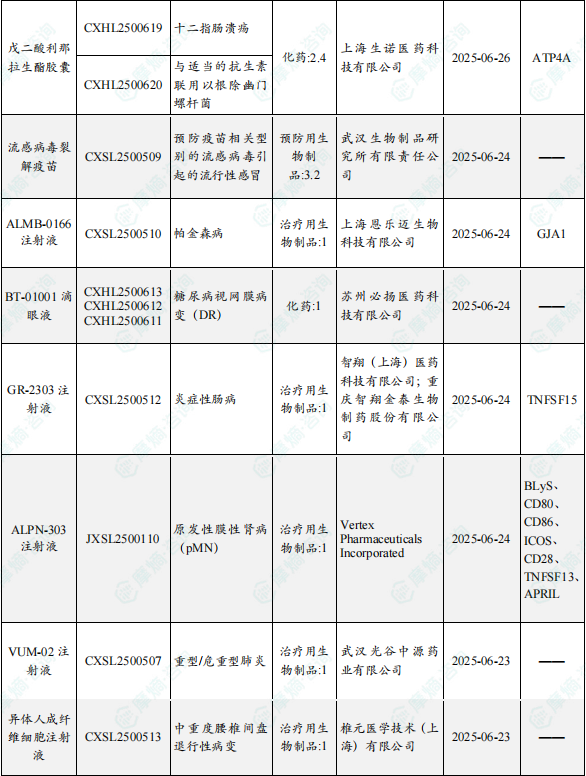
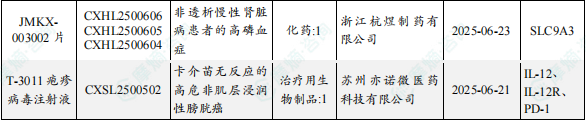
备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第37周09.08-09.14国内仿制药/生物类似物申报/审批数据分析
2. 2025年第37周09.08-09.14国内医药大健康行业政策法规汇总
3. 2025年第37周09.08-09.14全球创新药研发概览
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.08-2025.09.14) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论