【八月仿制药月报】内容亮点
8月国内新药获批临床情况
- 2025年8月共有177款新药获批临床(共计281个受理号),较上个月增加了21款;
- 8月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有153个,占比为54%;
- 8月获批剂型主要为注射剂与片剂,分别有131个,97个。
全球获孤儿药/突破性/快速通道资格认定品种盘点
- 8月共有57款药物获孤儿药/突破性/快速通道资格认定品种。
全球在研创新药积极/失败临床结果最新动态速递
- 中国首个天坛株艾滋病疫苗1期临床试验成功;
- 康方生物古莫奇单抗治疗强直性脊柱炎3期研究成功;
- 华东医药公布1类减重新药HDM1002片2期临床试验结果;
- 荣昌生物的泰它西普治疗IgA肾病国内3期临床A阶段达到主要终点。
每月相关创新药最新政策速递、国内新药注册申报、全球获孤儿药/突破性/快速通道资格认定品种盘点、全球在研创新药积极/失败临床结果TOP20、全球创新药研发进展TOP20等,摩熵咨询团队基于真实可溯源的全球医药数据,将每月推出「全球在研新药月报」,以期帮助业内人士通盘把握每月全球范围内的新药开发情况,全面而深入的了解全球新药开发动态。
一、8月国内新药获批临床/上市情况
根据摩熵医药数据库统计,2025年8月共有177款新药获批临床(共计281个受理号),较上个月增加了21款,其中包括70款化药,101款生物制品,6款中药。
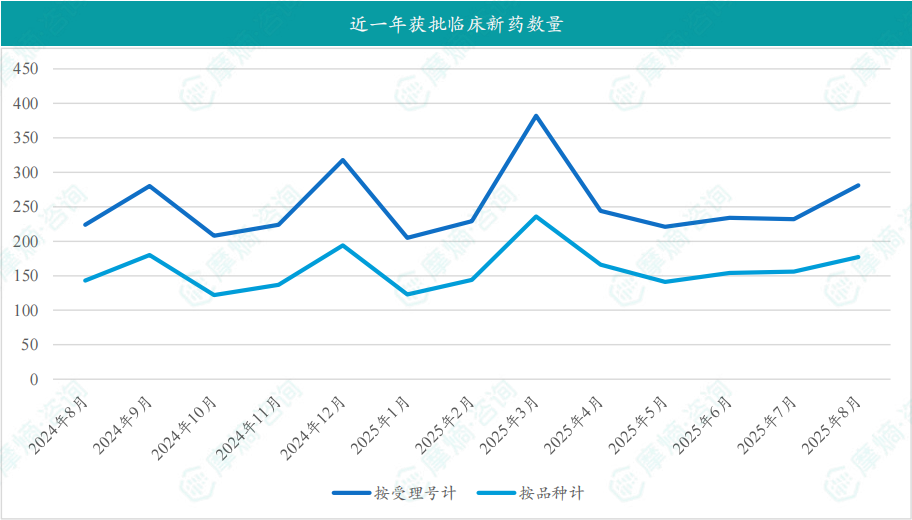
截图来源:摩熵咨询月报
8月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有153个,占比为54%,消化系统与代谢药物获批数量也比较多,有20个。获批剂型主要为注射剂与片剂,分别有131个,97个。
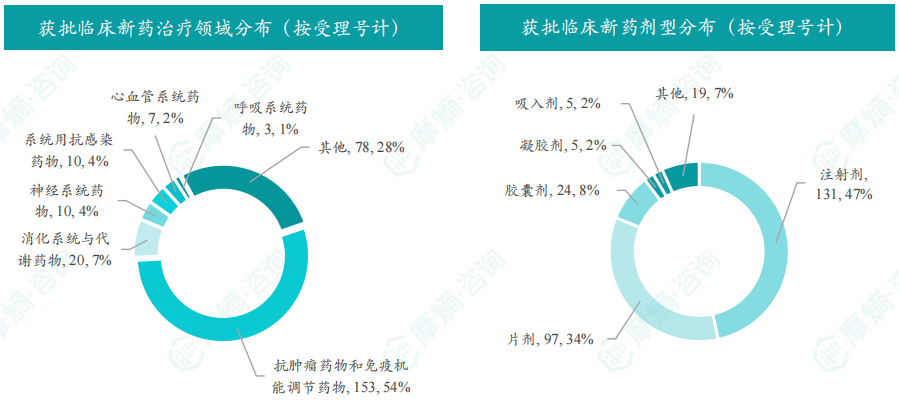
截图来源:摩熵咨询月报
在8月份,国内医药市场迎来了5款创新药物的获批上市,包括:
- 8月20日,诺华(Novartis)宣布创新产品盐酸阿曲生坦片获得中国国家药品监督管理局(NMPA)批准,用于降低有疾病快速进展风险的原发性免疫球蛋白A肾病(IgA肾病,IgAN)成人患者的蛋白尿;
- 8月22日,国家药监局官网显示,四环医药集团旗下非全资附属公司轩竹生物自主研发的抗肿瘤1类创新药地罗阿克片(产品代号:XZP-3621)获批上市,适用于未经过间变性淋巴瘤激酶(ALK)抑制剂治疗的ALK阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗;
- 8月22日,NMPA官网显示,第一三共/阿斯利康联合开发的TROP2 ADC德达博妥单抗(datopotamab deruxtecan,Dato-DXd)获批上市,用于治疗既往接受过内分泌治疗且在晚期疾病阶段接受过至少一线化疗的不可切除或转移性的激素受体(HR)阳性、人类表皮生长因子受体2(HER2)阴性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌成人患者;
- 8月25日,苏州晟济药业的重组人卵泡刺激素-CTP融合蛋白注射液获得国家药品监督管理局批准上市,该产品是国内首款获批上市的长效重组人卵泡刺激素(FSH-CTP);
- 8月22日,国家药品监督管理局通过优先审评审批程序批准武汉生物制品研究所有限责任公司申报的口服六价重配轮状病毒减毒活疫苗(Vero细胞)(商品名:武生儿轮宝)上市,适用于预防轮状病毒血清型G1、G2、G3、G4、G8、G9引起的婴幼儿急性胃肠炎。
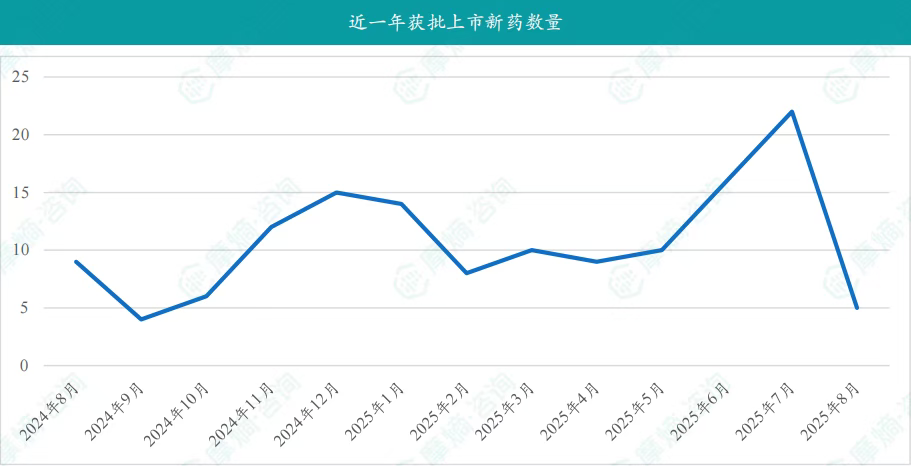
截图来源:摩熵咨询月报
二、全球获孤儿药/突破性/快速通道资格认定品种盘点
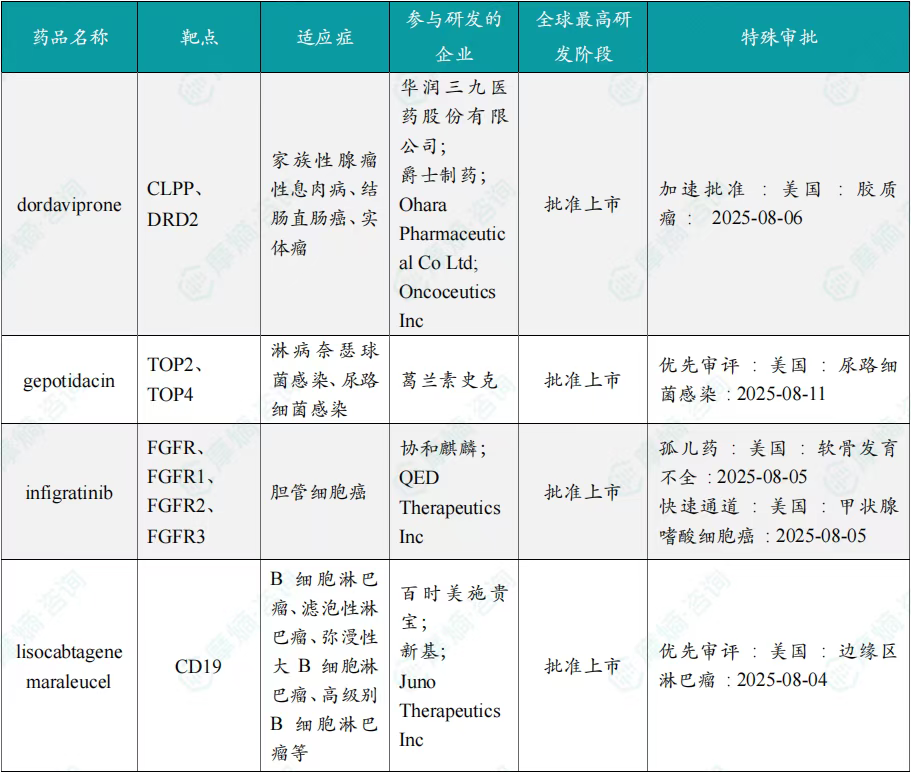
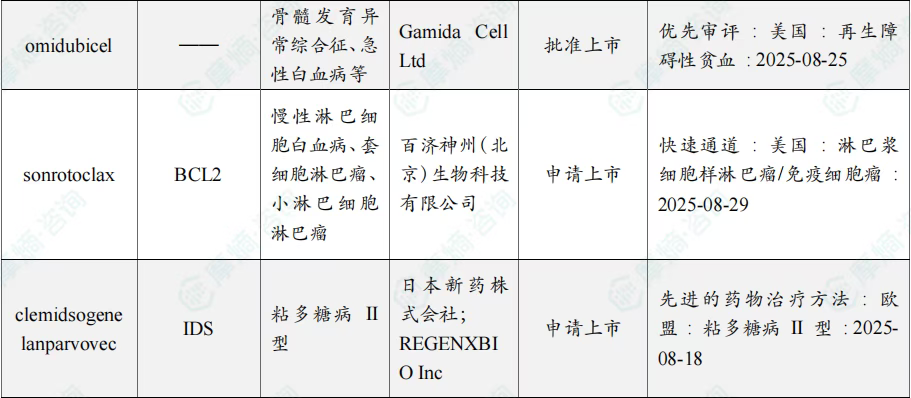
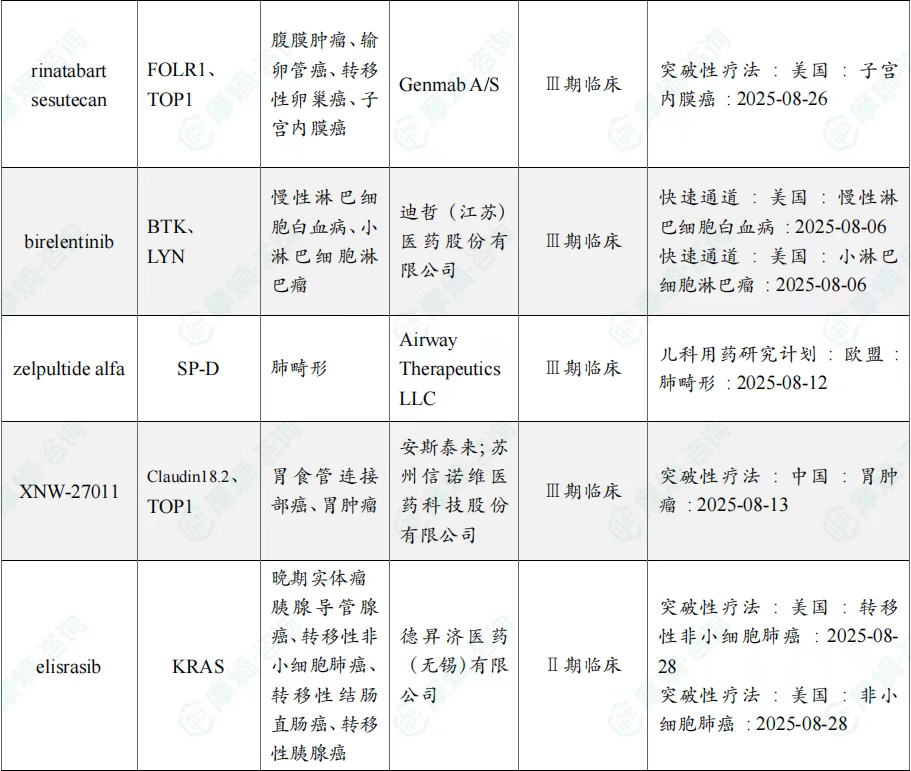
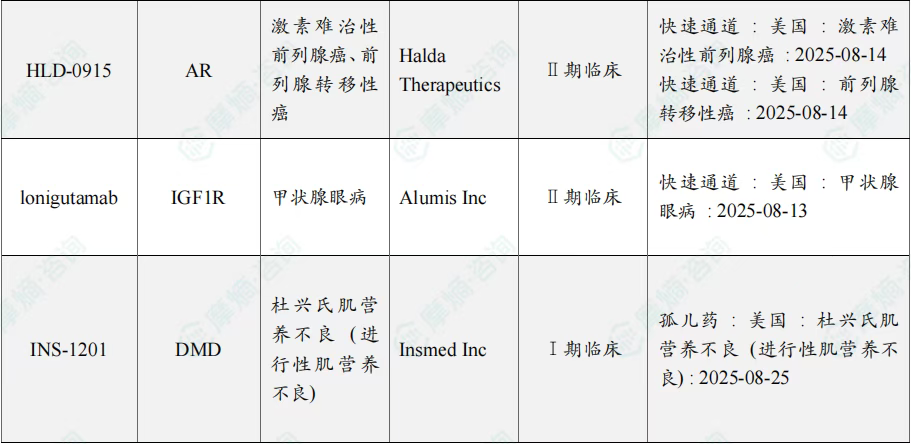
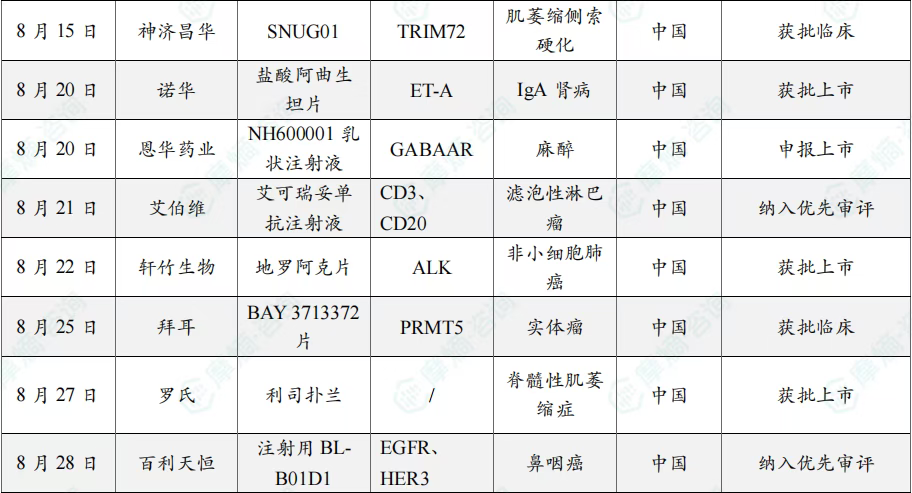
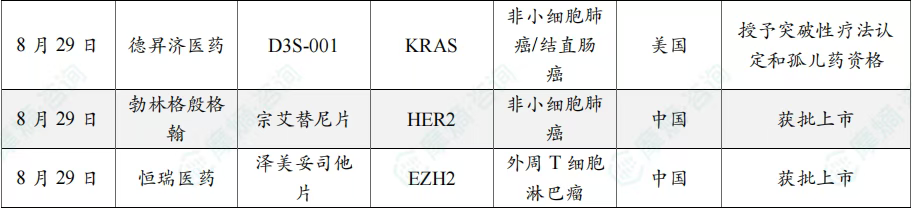
8月共有57款药物获孤儿药/突破性/快速通道资格认定。其中值得注意的是:华润三九医药股份有限公司、爵士制药、Ohara Pharmaceutical Co Ltd、Oncoceutics Inc共同参与研发的dordaviprone在美国加速批准,dordaviprone的适应症包括家族性腺瘤性息肉病、结肠直肠癌、实体瘤;百济神州(北京)生物科技有限公司的sonrotoclax上市申请进入快速通道,适应症为慢性淋巴细胞白血病、套细胞淋巴瘤、小淋巴细胞淋巴瘤。
8月全球孤儿药/突破性/快速通道资格认定品种一览表(部分)
三、全球在研创新药积极/失败临床结果TOP20
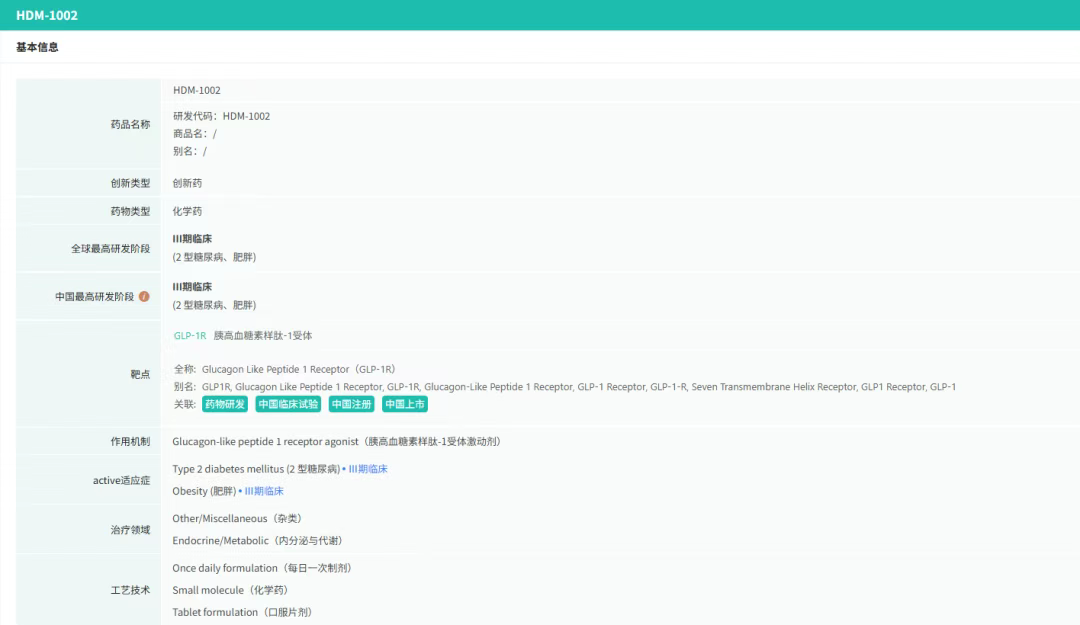
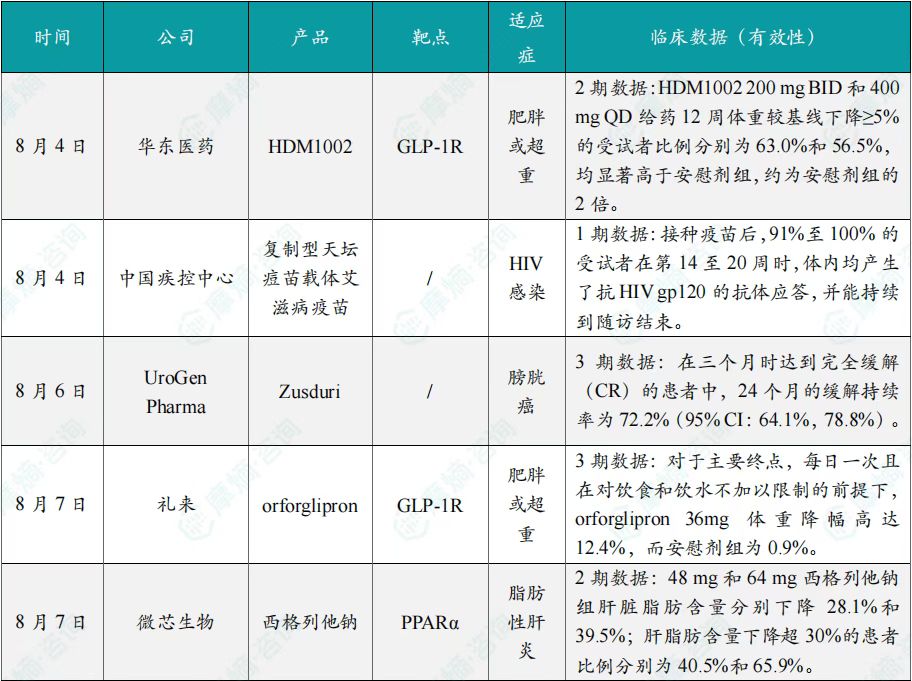
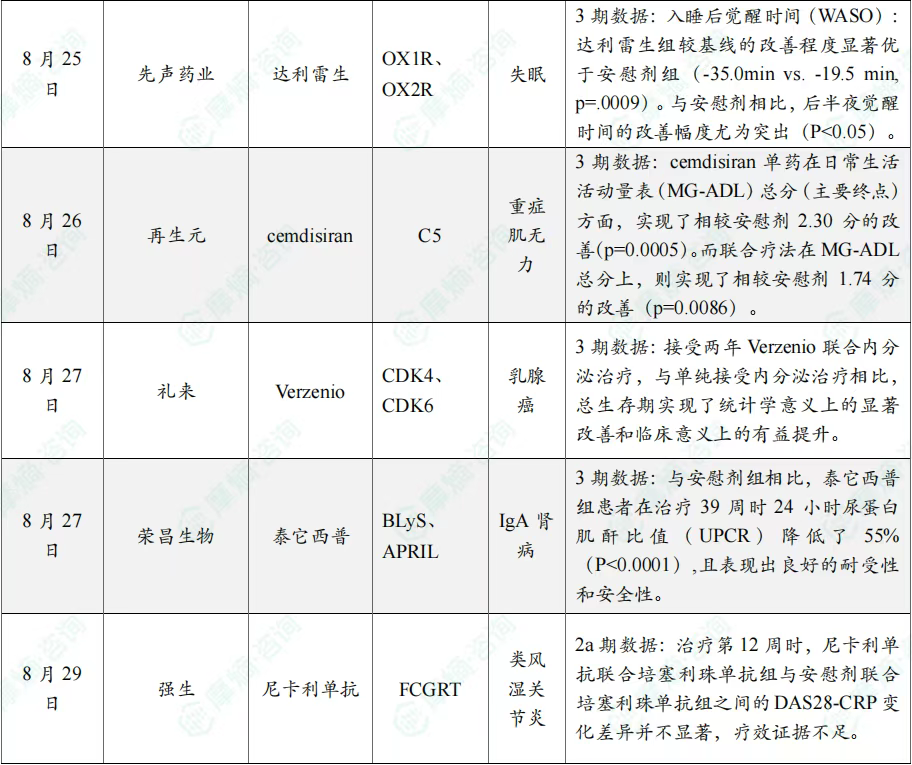
在8月全球创新药研发动态中,8月4日,华东医药自主研发的1类创新药口服小分子GLP-1受体激动剂HDM1002的减重Ⅱ期研究结果发布。HDM1002片用于超重或肥胖人群的体重管理的中国Ⅱ期临床试验是一项为期16周(包含4周安全性随访期)的多中心、随机、双盲、双模拟、安慰剂对照、平行入组试验(n=185例),旨在评估HDM1002片(100 mg BID/200 mg BID/400 mg QD,口服)在不伴糖尿病的肥胖或超重受试者中的安全性和有效性。该研究的主要终点为治疗第12周时受试者的体重相对于基线的百分比变化。
研究结果显示:HDM1002 100 mg BID组、HDM1002 200 mg BID组、HDM1002 400 mg QD组及安慰剂组给药12周后体重较基线变化百分比分别为-4.63%、-6.08%、-6.83%和-2.88%。其中HDM1002 200 mg BID组和400 mg QD组与安慰剂组比较均具有统计学显著性差异。
敏感性分析结果显示HDM1002 100 mg BID、200 mg BID、400 mg QD和安慰剂组给药12周后体重较基线变化百分比分别为-5.39%、-7.01%、-8.46%和-2.87%,与主分析结果一致。HDM1002 200 mg BID和400 mg QD给药12周体重较基线下降≥5%的受试者比例分别为63.0%和56.5%,均显著高于安慰剂组,约为安慰剂组的2倍。除此之外,给药12周后HDM1002各剂量组均可以观察到腰围、BMI、收缩压、HbA1c、谷丙转氨酶水平较基线值下降。
截图来源:摩熵医药全球药物研发数据库
同日(8月4日),中国疾控中心艾防中心联合北京协和医院等团队宣布,我国首个复制型天坛痘苗载体艾滋病疫苗顺利完成I期临床试验。在全球超过300次艾滋病疫苗试验折戟后,这一突破不仅终结了我国无原创艾滋病疫苗技术的历史,更为人类终结这场40年的健康之战带来曙光。
在严格控制的I期临床试验中,48名18-45岁健康志愿者分成两组:一组单独接种rTV,另一组先注射DNA疫苗再加强接种rTV。
安全性方面:88%志愿者出现轻微反应,主要是注射部位红肿、腋下淋巴结肿大,所有症状均在3天内自行消退,无任何严重不良事件。疫苗的安全性良好,出现的不良反应主要为接种部位的红肿、淋巴结肿大等,症状轻微且可自行恢复。
有效性方面:高剂量组成功诱导HIV gp120特异性IgG抗体,更激活多功能CD4+ T细胞——这两种免疫反应正是阻击艾滋病的关键武器。接种疫苗后,91%至100% 的受试者在第14至20周时,体内均产生了抗HIV gp120的抗体应答,并能持续到随访结束。
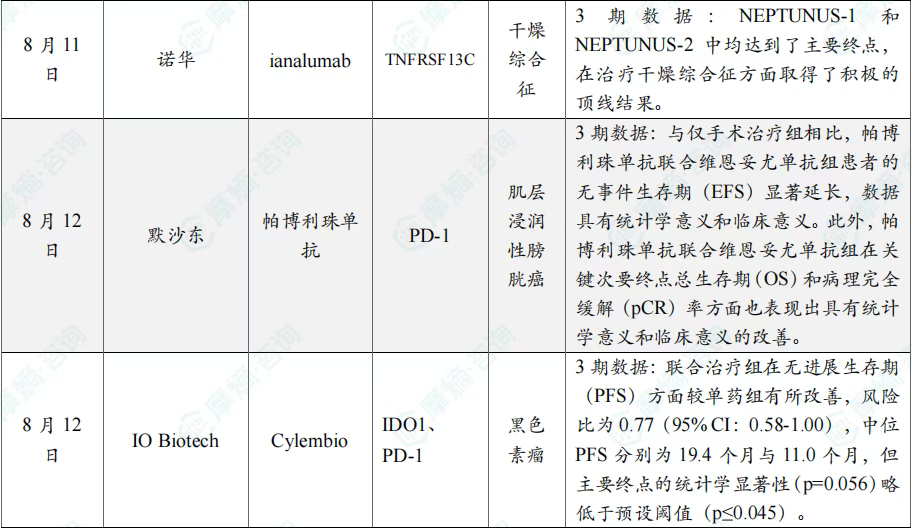
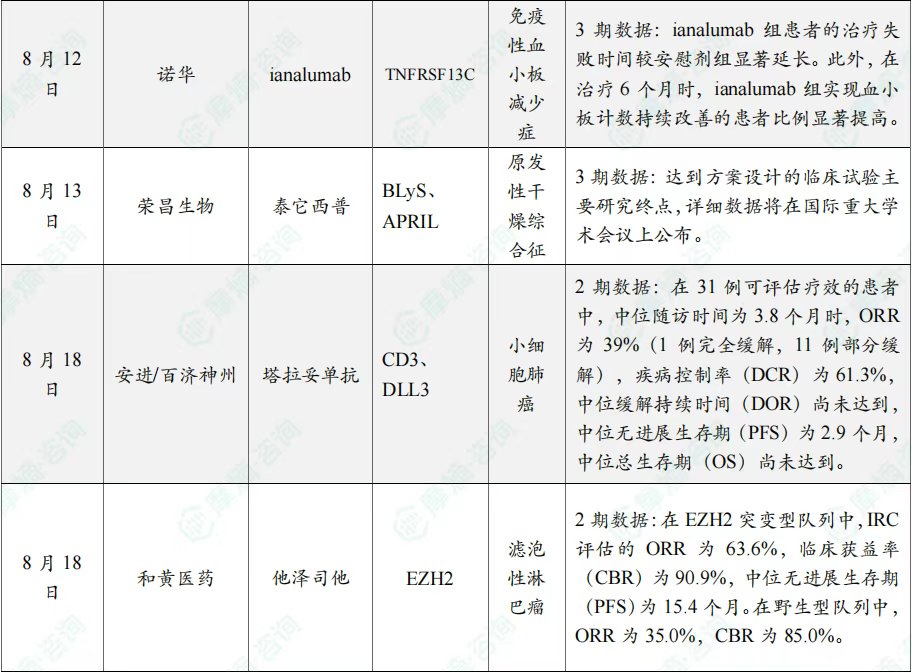
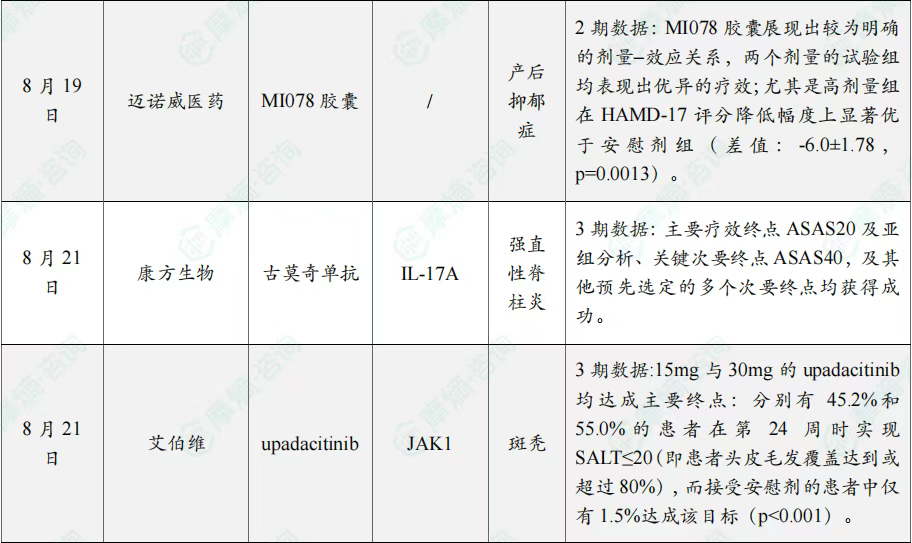
全球在研创新药积极/失败临床结果TOP20
四、全球创新药研发进展TOP20
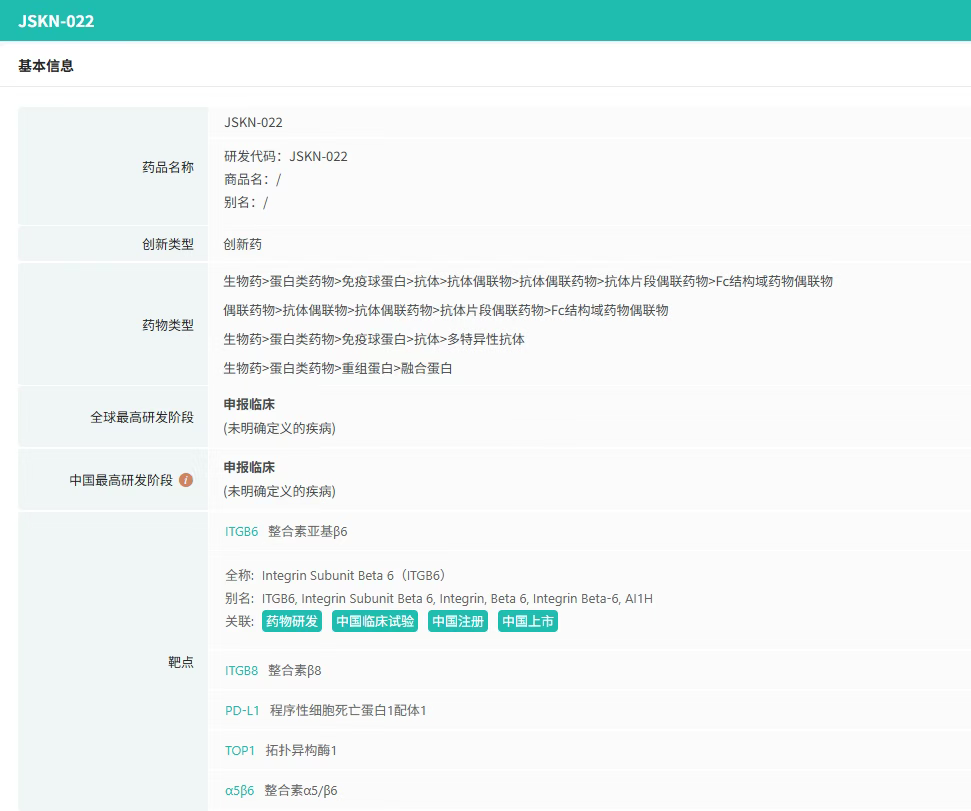
8月4日,康宁杰瑞宣布,公司自主研发的 PD-L1/αvβ6双特异性抗体偶联药物(ADC)JSKN022 新药临床试验(IND)申请,已获中国国家药品监督管理局药品审评中心(CDE)正式受理,即将开展用于晚期恶性实体瘤的首次人体临床研究。
JSKN022是康宁杰瑞基于糖基定点偶联平台开发的创新双抗ADC药物,可同时识别并结合肿瘤细胞表面的PD-L1与αvβ6整合素。康宁杰瑞以自主研发的恩沃利单抗为基础,创新性地将免疫(IO)机制与ADC技术相结合。该药物采用糖基定点偶联技术,提高了稳定性和均一性,通过可裂解连接子将拓扑异构酶Ⅰ抑制剂T01精准偶联至抗体上,提高疗效。该产品有望为PD-1/PD-L1抑制剂耐药或治疗无效的癌症患者提供全新的治疗选择。
截图来源:摩熵医药全球药物研发数据库
恒瑞医药在这个8月有两款新药传来了好消息!
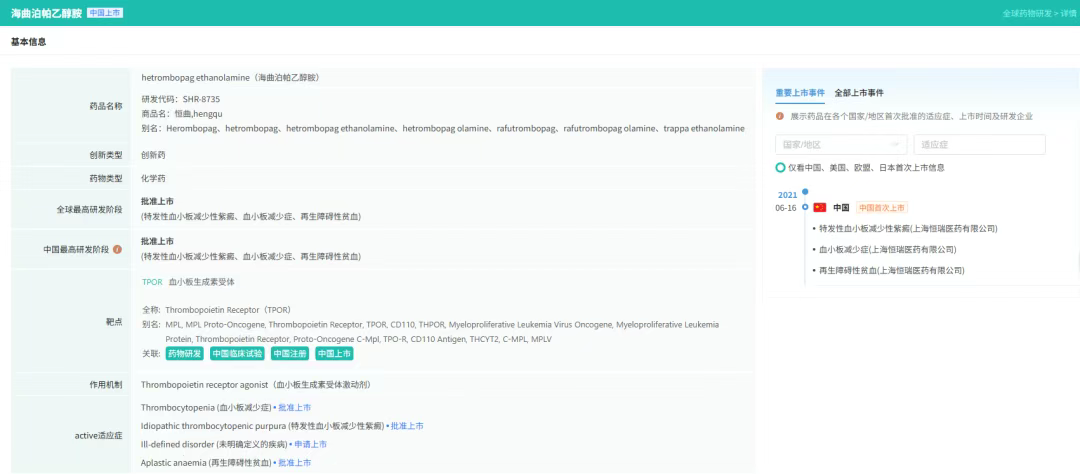
8月12日,恒瑞医药宣布其自主研发的1类新药海曲泊帕乙醇胺片的药品上市许可申请获中国国家药监局(NMPA)受理,适应症为:适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的原发免疫性血小板减少症(ITP)成人及≥6岁的儿童患者。
海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体激动剂,通过激活血小板生成素受体介导的STAT和MAPK信号转导通路,促进血小板生成。该产品已在原发免疫性血小板减少症、再生障碍性贫血、化疗所致血小板减少症、有创性操作或手术的慢性肝病伴血小板减少症患者中开展临床研究,以评估在不同血液系统疾病中的作用。
海曲泊帕乙醇胺片已获批上市两个适应症,分别为:2021年6月获得NMPA批准用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症成人患者的治疗,以及用于对免疫抑制治疗疗效不佳的重型再生障碍性贫血成人患者的治疗。此外,该产品用于恶性肿瘤化疗所致血小板减少症适应症(CIT)已获美国FDA授予孤儿药资格。
截图来源:摩熵医药全球药物研发数据库
8月29日,中国国家药监局宣布通过优先审评审批程序附条件批准恒瑞医药申报的1类创新药泽美妥司他片上市,该药品适用于既往接受过至少1线系统性治疗的复发或难治外周T细胞淋巴瘤成人患者。
全球创新药研发进展 TOP20
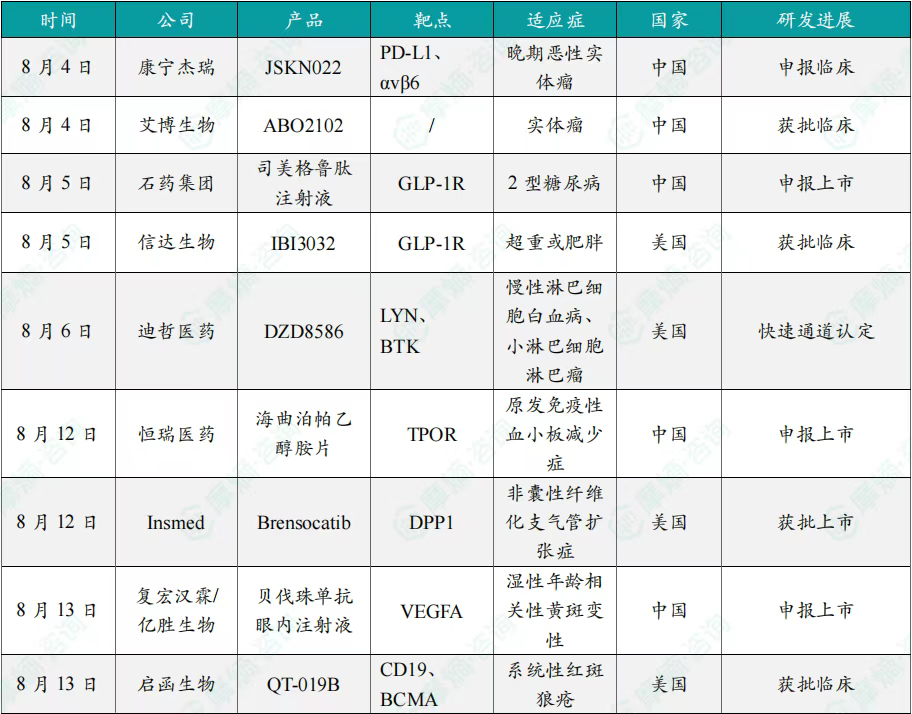
截图来源:摩熵咨询《2025年8月全球在研新药月报》
以上内容均来自摩熵咨询{2025年8月全球在研新药月报},如需查看或下载完整版报告,可点击!
想要解锁更多药企信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论