1.4.1本周全球TOP10创新药研发进展
(1)卫材/渤健的阿尔茨海默病新药仑卡奈单抗皮下注射制剂获FDA批准上市
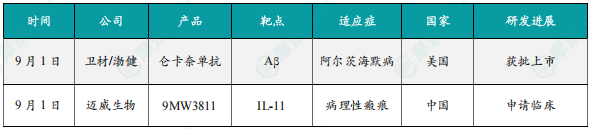
9月1日,卫材(Eisai)和渤健(Biogen)宣布,美国FDA已批准仑卡奈单抗皮下自动注射剂型用于早期阿尔茨海默病(AD)维持治疗,并将于2025年10月6日在美国上市。仑卡奈单抗皮下自动注射剂型是一款可在家中完成AD自动注射疗法,由卫材研发,该皮下自动注射器(SC-AI)含360mg/1.8mL(200mg/mL)剂量,可在约15秒内完成给药。仑卡奈单抗皮下自动注射剂型用于维持治疗患有轻度认知障碍及轻度痴呆的早期阿尔茨海默病(AD)患者。仑卡奈单抗是一种靶向淀粉样蛋白(Aβ)的单克隆抗体,可持续清除有神经毒性的原纤维即Aβ斑块,延缓病情进展。此次获批的新剂型,基于Clarity AD及其开放标签拓展数据,显示其临床和生物标志物获益与静脉给药相当,且安全性良好。与静脉输注相比,皮下注射大幅降低了全身反应发生率(<1% vs. 26%),且便于患者及其照护者在家完成治疗,减少就医频率。
(2)迈威生物靶向IL-11单抗9MW3811针对病理性瘢痕的2期临床试验申请获受理
9月1日,迈威生物宣布,其靶向IL-11单抗创新药9MW3811针对病理性瘢痕的2期临床试验申请已获得中国国家药品监督管理局(NMPA)正式受理,有望于2025年底启动该临床试验。白介素-11(IL-11)是一种在慢性炎症和纤维化相关疾病中发挥关键作用的细胞因子,广泛参与肺、皮肤、肾脏和肝脏等多个器官的纤维化进程,并与衰老相关疾病的发生密切相关(Nature,2024)。病理性瘢痕主要包括增生性瘢痕、瘢痕疙瘩、挛缩瘢痕等,在其形成过程中,IL-11的作用尤为突出。9MW3811是迈威生物自主研发的一款靶向人IL-11的人源化单克隆抗体。该产品通过高亲和力结合IL-11,有效抑制IL-11/IL-11Rα信号通路的异常激活,从而干预纤维化相关疾病的病理进展。其核心潜在优势包括:(1)更高的靶点亲和力与信号阻断能力;(2)超过一个月的长半衰期,更适用于需要长期给药的慢性疾病治疗。
(3)翰森制药的伊奈利珠单抗获批新适应症
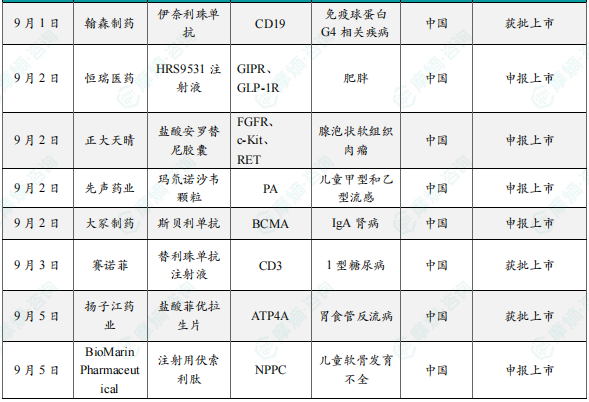
9月1日,国家药监局(NMPA)网站显示,翰森制药旗下子公司常州恒邦药业的伊奈利珠单抗(inebilizumab)获批新适应症,用于治疗免疫球蛋白G4相关疾病(IgG4-RD)成人患者。伊奈利珠单抗是全球首个获批治疗IgG4-RD的药物。伊奈利珠单抗是Viela Bio(于2021年被Horizon收购,Horizon在2023年被安进收购)开发的一款抗CD19单抗,于2020年6月首次在美国获批上市,并于2022年3月在中国获批,用于治疗抗水通道蛋白4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)成人患者。2019年5月,翰森制药与Viela Bio达成合作协议,获得该药物的中国开发和商业化权益。2024年6月,伊奈利珠单抗治疗IgG4-RD的III期MITIGATE研究取得了积极结果。该药物是首个在IgG4-RD适应症上取得积极III期研究结果的产品。
(4)恒瑞医药1类新药HRS9531注射液申报上市
9月2日,中国国家药监局药品审评中心(CDE)官网公示,恒瑞医药申报的1类创新药HRS9531注射液的上市申请获受理,适应症为:本品适用于在控制饮食和增加运动基础上,初始体重指数(BMI)符合以下要求的成人的长期体重管理:≥28kg/㎡(肥胖),或≥24kg/㎡(超重)并伴有至少一种体重相关合并症(例如高血糖、高血压、血脂异常、阻塞性睡眠呼吸暂停、脂肪肝等)。HRS9531注射液是恒瑞医药自主研发的胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)双重受体激动剂,具有改善胰岛素抵抗、抑制食欲、降低血糖和减轻体重等作用。HRS9531注射液已获得中国国家药监局(NMPA)批准用于开展2型糖尿病、超重或肥胖和阻塞性睡眠呼吸暂停适应症的临床试验。
(5)正大天晴的盐酸安罗替尼胶囊组合疗法新适应症申报上市
9月2日,正大天晴宣布其创新药组合——贝莫苏拜单抗注射液联合盐酸安罗替尼胶囊新适应症的上市申请获得中国国家药品监督管理局药品审评中心(CDE)受理。这是该组合申报上市的第六个适应症,拟用于治疗晚期或不可切除腺泡状软组织肉瘤(ASPS)。与此同时,CDE官网显示,盐酸安罗替尼胶囊目前已经被拟纳入优先审评,针对适应症即为晚期或不可切除腺泡状软组织肉瘤。贝莫苏拜单抗是一款创新人源化抗PD-L1单克隆抗体,盐酸安罗替尼胶囊是一款口服新型小分子多靶点酪氨酸激酶抑制剂。贝莫苏拜单抗联合安罗替尼这一联合疗法用于治疗广泛期小细胞肺癌、子宫内膜癌、肾细胞癌的三项适应症已获批上市,一线治疗鳞状非小细胞肺癌和同步/序贯放化疗后未进展的局部晚期/不可切除非小细胞肺癌巩固治疗两项适应症上市申请正在审评中。免疫联合抗血管生成的组合治疗模式将为肿瘤患者提供更多元的治疗选择。
(6)先声药业的儿童版抗流感病毒创新药玛氘诺沙韦颗粒申报上市
9月2日,先声药业集团宣布,与安帝康生物合作开发的国产首创“儿童版”抗流感病毒新药玛氘诺沙韦颗粒(先林达颗粒)上市申请获国家药品监督管理局正式受理,拟用于2-11岁儿童无并发症的甲型和乙型流感的治疗。这是中国首个成功完成III期临床并申报上市的针对儿童患者的抗流感病毒创新药,有望实现儿童流感“一袋治愈”。此外,玛氘诺沙韦颗粒在流感预防领域也取得进展。其用于2岁及以上人群甲型和乙型流感暴露后预防的适应症已获得临床试验默示许可。儿童暴露于流感病毒后有望通过“一袋预防”降低发病风险。玛氘诺沙韦是一款Cap依赖型核酸内切酶抑制剂,通过抑制流感病毒复制所必需的cap依赖型核酸内切酶,阻断病毒mRNA转录,从而精准抑制病毒复制。2023年10月,先声药业从安帝康生物获得玛氘诺沙韦的流感适应症在中国的独家商业化权益。
(7)大冢制药的斯贝利单抗在中国申报上市
9月2日,CDE网站显示,大冢制药(Otsuka Pharmaceutical)的斯贝利单抗(Sibeprenlimab)在国内申报上市,治疗原发性免疫球蛋白A肾病(IgA肾病)成人患者,以维持肾脏功能。该药物已于今年3月在美国申报上市并在5月获得了优先审评,PDUFA时间为2025年11月28日。斯贝利单抗是Visterra开发的一款靶向抑制增殖诱导配体(APRIL)的单抗。APRIL是肿瘤坏死因子(TNF)家族中的一种细胞因子,在IgAN的“四重打击(4-hit)”发病机制中扮演着关键角色,通过促进致病性半乳糖缺陷型IgA1(Gd-IgA1)抗体的产生和免疫复合物的形成影响IgAN的进展。目前,全球已有四款药物获批用于治疗IgA肾病,包括Nefecon(胶囊,16mg,每日1次)、司帕生坦(片剂,200/400mg,每日1次)、伊普可泮(胶囊,200mg,每日2次)和阿曲生坦(片剂,0.75mg,每日1次)。斯贝利单抗是第一款提交上市申请的APRIL靶向药物。
(8)赛诺菲用于延缓1型糖尿病进展的创新药替利珠单抗注射液在华获批
9月3日,赛诺菲宣布替利珠单抗注射液(teplizumab)获批上市,用于延缓成人和8岁及以上儿童1型糖尿病患者从2期进展至3期。替利珠单抗是MacroGenics开发的一款CD3单抗,通过与效应T细胞表面的CD3结合,抑制T细胞对胰岛β细胞的攻击,从而保护胰岛β细胞不受破坏。替利珠单抗的Fc段经氨基酸修饰后,构成了Fc受体非结合(FNB)区域,可减少其与补体和Fc受体的结合从而降低相关毒性反应。2007年10月,礼来与MacroGenics达成协议,以6.41亿美元的总交易额获得替利珠单抗的开发与商业化权益。不过,礼来在三年后终止了双方的合作。2018年5月,Provention Bio从MacroGenics手中收购了替利珠单抗的所有权益,并将其作为核心产品,公司也基于此募资5600万美元IPO。2022年10月,赛诺菲与Provention Bio达成合作,获得替利珠单抗的美国商业化权益。该产品在2022年11月获FDA批准上市。而后,赛诺菲出手29亿美元并购Provention Bio,获得该产品的所有权益。
(9)扬子江药业新一代质子泵抑制剂菲优拉生获批上市
9月5日,国家药品监督管理局(NMPA)官网显示,扬子江与Daewoong Pharmaceutical(大熊制药)合作开发的盐酸菲优拉生片(fexuprazan,曾用名:非苏拉赞)获批上市,根据其注册临床研究信息,推测其适应症为:用于治疗反流性食管炎。盐酸菲优拉生片是一款新型钾离子竞争性酸阻滞剂(P-CAB)、新一代质子泵抑制剂(PPI),能够可逆地阻断分泌胃酸的质子泵,治疗胃食管反流病。2021年3月,扬子江药业子公司海尼药业与大熊制药就盐酸菲优拉生片达成合作。根据协议条款,海尼药业获得该药在中国的研发和商业化权益,向大熊制药最高支付3800亿韩元(3.38亿美元),包括68亿韩元首付款和136亿韩元里程碑付款。海尼药业负责盐酸菲优拉生片的临床开发和审批程序,扬子江药业负责整个市场销售。
(10)全球首款儿童软骨发育不全治疗药物注射用伏索利肽在国内申报上市
9月5日,国家药品监督管理局(NMPA)药品审评中心(CDE)官网显示,BioMarin Pharmaceutical开发的注射用伏索利肽的上市申请已获受理,根据其注册临床研究信息,推测其适应症为儿童软骨发育不全。伏索利肽是一种C型利钠肽(CNP)类似物。在软骨发育不全患者中,由于成纤维细胞生长因子受体3基因(FGFR3)发生功能获得性突变,软骨内骨生长(骨组织生成的一个重要过程)受到负向调控。伏索利肽作为FGFR3下游信号通路的正向调节剂,可促进软骨内骨生长。2021年11月,美国FDA加速批该药用于增加5岁及以上骨骺(生长板)未闭合的软骨发育不全儿科患者的线性生长。该药是FDA批准的首个用于软骨发育不全儿童的治疗药物。
1.4.2本周全球TOP10积极/失败临床结果
(1)Antiva Biosciences公司公布宫颈感染药物ABI-2280 1b/2期临床试验积极结果
9月1日,Antiva Biosciences公司宣布,其治疗hrHPV宫颈感染的局部外用疗法ABI-2280的1b/2期临床试验取得积极的顶线结果。ABI-2280是一种PMEG二磷酸盐的无环核苷膦酸酯前药,可经阴道由患者自行给药。该药物能快速被宫颈上皮细胞吸收,达到有效治疗浓度,同时最大限度减少全身暴露,从而降低系统性毒性风险。ABI-2280具有独特的双重抗增殖和抗病毒作用机制:它通过直接抑制HPV复制所依赖的人类DNA聚合酶发挥作用,能诱导感染细胞凋亡,同时保护未感染的正常细胞。由于其靶点是人体DNA聚合酶而非特定病毒蛋白,ABI-2280对所有HPV亚型均具有广谱活性,有望治疗全球范围内的各种HPV感染,且不易产生耐药性,并可能对免疫功能低下(如HIV感染者)的患者也有效。
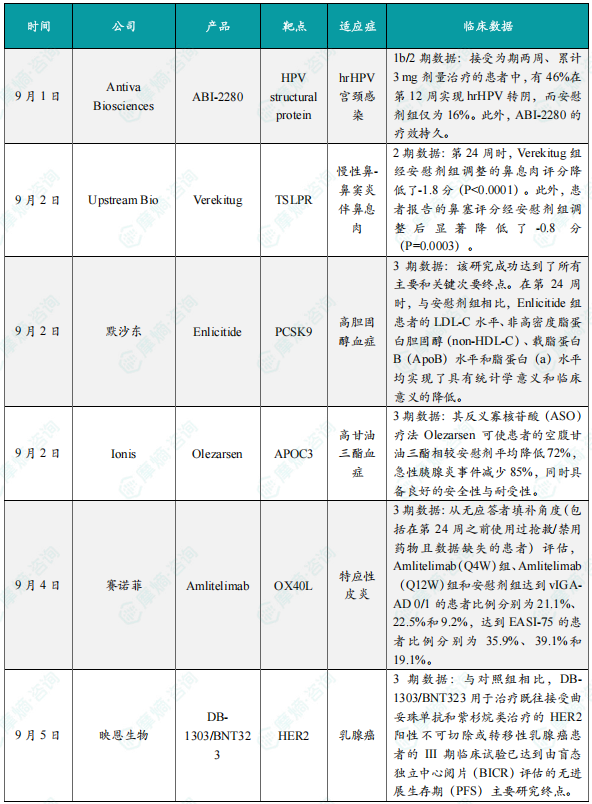
此次公布的结果显示,该临床试验达到了主要终点和所有次要终点。在治疗第12周,接受ABI-2280治疗的患者hrHPV转阴率显著高于安慰剂组(具有统计学意义)。具体而言,接受为期两周、累计3 mg剂量治疗的患者中,有46%在第12周实现hrHPV转阴,而安慰剂组仅为16%。此外,ABI-2280的疗效持久。根据中期数据,在第12周实现hrHPV转阴的患者中,有87%在第24周仍维持hrHPV阴性状态。安全性方面,ABI-2280表现出良好的耐受性,最常见的不良事件均为轻度或中度,且局限于用药部位。
(2)Upstream Bio全球首创抗TSLP受体单抗Verekitug 2期临床取得积极结果
9月2日,Upstream Bio宣布Verekitug(UPB-101)治疗慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)的II期VIBRANT研究取得了积极结果。Verekitug是安斯泰来开发的一种靶向胸腺基质淋巴细胞生成素(TSLP)受体的新型重组全人免疫球蛋白G1(IgG1)单克隆抗体,可与TSLP受体结合并抑制TSLP介导的促炎性信号传导,从而起到治疗哮喘等炎症性疾病的作用。VIBRANT研究是一项全球性、多中心、随机、双盲、安慰剂对照临床试验(n=81),旨在评估Verekitug(100mg,每12周1次,皮下注射)治疗在背景治疗中接受鼻内皮质类固醇治疗的CRSwNP成人患者的疗效和安全性。研究的主要终点是第24周时内窥镜鼻息肉评分较基线的变化。结果表明,第24周时,Verekitug组经安慰剂组调整的鼻息肉评分降低了-1.8分(P<0.0001)。此外,患者报告的鼻塞评分经安慰剂组调整后显著降低了-0.8分(P=0.0003)。其他关键次要终点也实现了显著改善,包括鼻窦混浊程度减轻、全身性皮质类固醇或鼻息肉手术需求减少以及总症状评分(TSS)下降。
(3)默沙东的Enlicitide治疗高胆固醇血症3期研究取得积极结果
9月2日,默沙东宣布Enlicitide治疗高胆固醇血症的III期CORALreef Lipids研究取得了积极结果。该研究是Enlicitide目前已完成的最大规模的III期研究。此前,该药物已顺利完成两项III期研究。CORALreef Lipids研究是一项随机、双盲、安慰剂对照临床试验(n=),评估了Enlicitide在接受稳定降脂疗法(包括至少一种他汀类药物)治疗或对他汀类药物不耐受的有主要动脉粥样硬化性心血管疾病(ASCVD)事件史或首次ASCVD事件风险增加的高胆固醇血症成人患者中的疗效、安全性和耐受性。研究的主要终点是治疗第24周时低密度脂蛋白胆固醇(LDL-C)水平相对于基线的平均百分比变化。结果显示,该研究成功达到了所有主要和关键次要终点。在第24周时,与安慰剂组相比,Enlicitide组患者的LDL-C水平、非高密度脂蛋白胆固醇(non-HDL-C)、载脂蛋白B(ApoB)水平和脂蛋白(a)水平均实现了具有统计学意义和临床意义的降低。安全性方面,两个治疗组之间报告不良事件(AE)和严重不良事件(SAE)的患者比例没有临床意义的差异。两个治疗组因AE导致的停药率均较低且类似。
(4)Ionis的Olezarsen 3期研究取得积极结果,针对高甘油三酯血症
9月2日,小核酸龙头Ionis宣布,其在严重高甘油三酯血症(sHTG)患者中开展的关键性3期CORE和CORE2研究取得积极结果。数据显示,其反义寡核苷酸(ASO)疗法Olezarsen可使患者的空腹甘油三酯相较安慰剂平均降低72%,急性胰腺炎事件减少85%,同时具备良好的安全性与耐受性。基于此积极结果,Ionis计划在年底前向美国FDA提交补充新药申请(sNDA),lonis的股价也顺势暴涨近35%。Olezarsen是一种靶向APOC3 mRNA的ASO。此前,Olezarsen已于2024年12月获得美国FDA批准用于作为饮食控制的辅助治疗,以降低家族性乳糜微粒血症综合征(FCS)成人患者的甘油三酯。如果新适应症获得批准,Olezarsen将拓展适应症成为lonis旗下首款面向广泛人群的ASO疗法。
(5)赛诺菲全球首创OX40L单抗Amlitelimab 3期研究成功
9月4日,赛诺菲宣布Amlitelimab治疗特应性皮炎的III期COAST 1研究达到了所有主要终点和次要终点。Amlitelimab是赛诺菲开发的一款靶向OX40L(OX40配体)的全人源非T细胞耗竭性单克隆抗体,可阻断关键免疫调节因子OX40L与其受体OX40结合,并保持促炎性T细胞和调节性T细胞之间的平衡,进而起到治疗特应性皮炎、哮喘、化脓性汗腺炎等一系列免疫性疾病和炎症性疾病的作用。该药物是目前唯一一款III期阶段OX40L抗体。COAST 1研究是一项全球性、多中心、随机、双盲、安慰剂对照临床试验(n=601),评估了Amlitelimab对比安慰剂治疗患有中重度特应性皮炎的12岁及以上青少年和成人患者的有效性和安全性。在该研究中,试验组患者首先接受负荷剂量为500mg(体重低于40kg则减为250mg)的Amlitelimab治疗,随后接受每4周1次(Q4W)或每12周1次(Q12W)的Amlitelimab(250mg,体重低于40kg则减为125mg)治疗。结果显示,从无应答者填补角度(包括在第24周之前使用过抢救/禁用药物且数据缺失的患者)评估,Amlitelimab(Q4W)组、Amlitelimab(Q12W)组和安慰剂组达到vIGA-AD 0/1的患者比例分别为21.1%、22.5%和9.2%,达到EASI-75的患者比例分别为35.9%、39.1%和19.1%。若从治疗策略角度(包括在第24周之前使用过急救药物的患者)评估,Amlitelimab(Q4W)组、Amlitelimab(Q12W)组和安慰剂组达到vIGA-AD 0/1的患者比例分别为26.5%、29.1%和10.5%,达到EASI-75的患者比例分别为46.0%、50.3%和27.6%。此外,在两个治疗组中,在治疗期间观察到疗效逐渐增加,没有平台期。
(6)映恩生物的DB-1303/BNT323治疗乳腺癌3期临床研究成功
9月5日,映恩生物宣布,经独立数据监查委员会(IDMC)评估,与对照组相比,DB-1303/BNT323用于治疗既往接受曲妥珠单抗和紫杉烷类治疗的HER2阳性不可切除或转移性乳腺癌患者的III期临床试验已达到由盲态独立中心阅片(BICR)评估的无进展生存期(PFS)主要研究终点。根据这项中期分析结果,公司计划与中国国家药品监督管理局药品审评中心就提交DB-1303/BNT323的药品上市许可申请(BLA)进行沟通。该试验是一项在中国进行的随机、对照、开放标签、多中心的III期临床试验,旨在评估DB-1303/BNT323相较于T-DM1在既往接受曲妥珠单抗和紫杉烷类治疗的HER2阳性不可切除或转移性乳腺癌患者中的疗效和安全性。DB-1303/BNT323已获得FDA授予的快速通道及突破性疗法认定以及国家药监局授予的突破性疗法认定,用于治疗在接受免疫检查点抑制剂治疗时或治疗后出现疾病进展的HER2表达晚期子宫内膜癌患者。此外,在一系列肿瘤(包括乳腺癌、子宫内膜癌、卵巢癌、结直肠癌及食管癌)中均观察到DB-1303/BNT323的治疗反应,并得到来自美国、中国、澳大利亚及其他国家患者的全球临床数据的支持。
(7)罗氏公布眼科药物Vabysmo最新临床研究数据
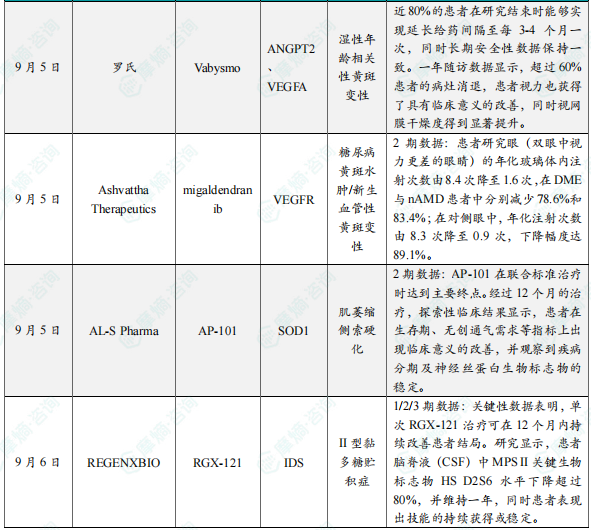
9月5日,罗氏(Roche)公布其眼科药物Vabysmo(faricimab)的最新研究数据。研究显示,在新生血管性或湿性年龄相关性黄斑变性(nAMD)患者中,Vabysmo在长达四年的随访中持续展现出持久疗效和良好安全性。AVONELLE-X试验结果表明,近80%的患者在研究结束时能够实现延长给药间隔至每3-4个月一次,同时长期安全性数据保持一致。此外,在治疗第1年视力优于20/40的患者中,有75%在治疗第4年时仍维持在这一水平。与此同时,单臂SALWEEN研究在nAMD亚型脉络膜息肉样血管病变(PCV)患者中进一步展示了Vabysmo的潜力。一年随访数据显示,超过60%患者的病灶消退,患者视力也获得了具有临床意义的改善,同时视网膜干燥度得到显著提升。Vabysmo是一款双特异性抗体,可同时靶向阻断两条致病关键通路——血管生成素-2(Ang-2)和血管内皮生长因子-A(VEGF-A),这两种通路都能破坏血管的稳定性,使血管发生渗漏,增加炎症的发生,从而驱动许多可导致视力丧失的视网膜疾病。同时靶向这两条通路可以起到一定的互补作用,因此Vabysmo有望稳定血管,改善患者的视力。
(8)Ashvattha Therapeutics公布在研药物migaldendranib 2期临床积极结果
9月5日,Ashvattha Therapeutics宣布,其在研药物migaldendranib(MGB)在治疗糖尿病黄斑水肿(DME)和新生血管性年龄相关性黄斑变性(nAMD)的2期临床研究中取得积极的顶线结果。MGB为一款新型靶向纳米药物,通过正常化VEGF表达发挥作用。它通过皮下注射给药,并精准靶向炎症组织中被激活的细胞。分析显示,MGB显著减少了患者双眼对补充玻璃体腔内抗VEGF注射的需求。患者研究眼(双眼中视力更差的眼睛)的年化玻璃体内注射次数由8.4次降至1.6次,在DME与nAMD患者中分别减少78.6%和83.4%;在对侧眼中,年化注射次数由8.3次降至0.9次,下降幅度达89.1%。此外,DME患者研究眼在40周时最佳矫正视力平均提高6.1个ETDRS字母,中央黄斑厚度减少23.3 μm。MGB安全性良好,未观察到与治疗相关的严重眼部或系统性不良事件。以上结果显示,每月一次皮下注射MGB不仅可在家中安全使用,还能发挥双眼治疗效果,有望成为频繁眼内注射之外的新选择。
(9)AL-S Pharma在研药物AP-101 2期临床取得积极结果
9月5日,AL-S Pharma宣布,其在研药物AP-101在2期临床试验中取得积极主要结果。AP-101是一款潜在“first-in-class”单克隆抗体,靶向错误折叠的SOD1蛋白,这一病理机制与散发性肌萎缩侧索硬化(ALS)及突变型SOD1-ALS均密切相关。该研究为多中心、随机、双盲、安慰剂对照设计,共纳入52例散发性ALS患者和21例突变型SOD1-ALS患者。研究为期24周,之后进入24周的开放标签延长期,并设置随访以进一步评估安全性。分析显示,AP-101在联合标准治疗时达到主要终点。经过12个月的治疗,探索性临床结果显示,患者在生存期、无创通气需求等指标上出现临床意义的改善,并观察到疾病分期及神经丝蛋白生物标志物的稳定。该药物表现出良好的安全性和耐受性。
(10)REGENXBIO在研基因疗法RGX-121 1/2/3期临床试验取得积极结果
9月6日,REGENXBIO宣布,其在研基因疗法clemidsogene lanparvovec(RGX-121)用于治疗II型黏多糖贮积症(MPS II,亦称亨特综合征)的1/2/3期CAMPSIITE临床试验取得积极结果。此次公布的长期关键性数据已提交至美国FDA,以作为RGX-121生物制品许可申请(BLA)审评过程中信息要求的回应。根据新闻稿,若获批准,RGX-121将成为从根本上直接针对MPS II遗传病因的首个一次性给药疗法。关键性数据表明,单次RGX-121治疗可在12个月内持续改善患者结局。研究显示,患者脑脊液(CSF)中MPS II关键生物标志物HS D2S6水平下降超过80%,并维持一年,同时患者表现出技能的持续获得或稳定。试验在第16周达到主要终点,即CSF HS D2S6水平显著降低。此外,一年随访结果显示,CSF HS D2S6水平与神经发育结局存在强相关性,从而支持HS D2S6作为预测临床获益的替代生物标志物。
同期事件:
1. 2025年第36周09.01-09.07国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第36周09.01-09.07国内仿制药/生物类似物申报/审批数据分析
3.2025年第36周09.01-09.07国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.01-2025.09.07) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论