
9月17日,恒瑞医药发布公告,公司注射用瑞康曲妥珠单抗(SHR-A1811)用于治疗既往接受过一种或一种以上抗HER2药物治疗的局部晚期或转移性HER2阳性成人乳腺癌患者的新适应症上市许可申请获国家药监局受理,且已被纳入优先审评程序。

乳腺癌位居全球女性恶性肿瘤发病率与死亡率前列,对女性健康造成了严重威胁。而HER2阳性乳腺癌约占所有乳腺癌的15-20%,抗HER2的药物问世以前,HER2阳性乳腺癌患者的平均生存期仅为阴性患者的一半。抗HER2药物的出现,极大地改变了HER2阳性乳腺癌的病程和治疗结局。但HER2阳性晚期乳腺癌存在巨大的未被满足的治疗需求,包括药物选择少、耐药出现早或不良事件限制药物应用等,临床亟需探索疗效优、耐受性良好的方案。
注射用瑞康曲妥珠单抗可通过与HER2表达的肿瘤细胞结合并内吞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导细胞周期阻滞从而诱导肿瘤细胞凋亡。其释放的毒素具有高透膜性,可发挥旁观者杀伤效应,进一步提高抗肿瘤疗效。
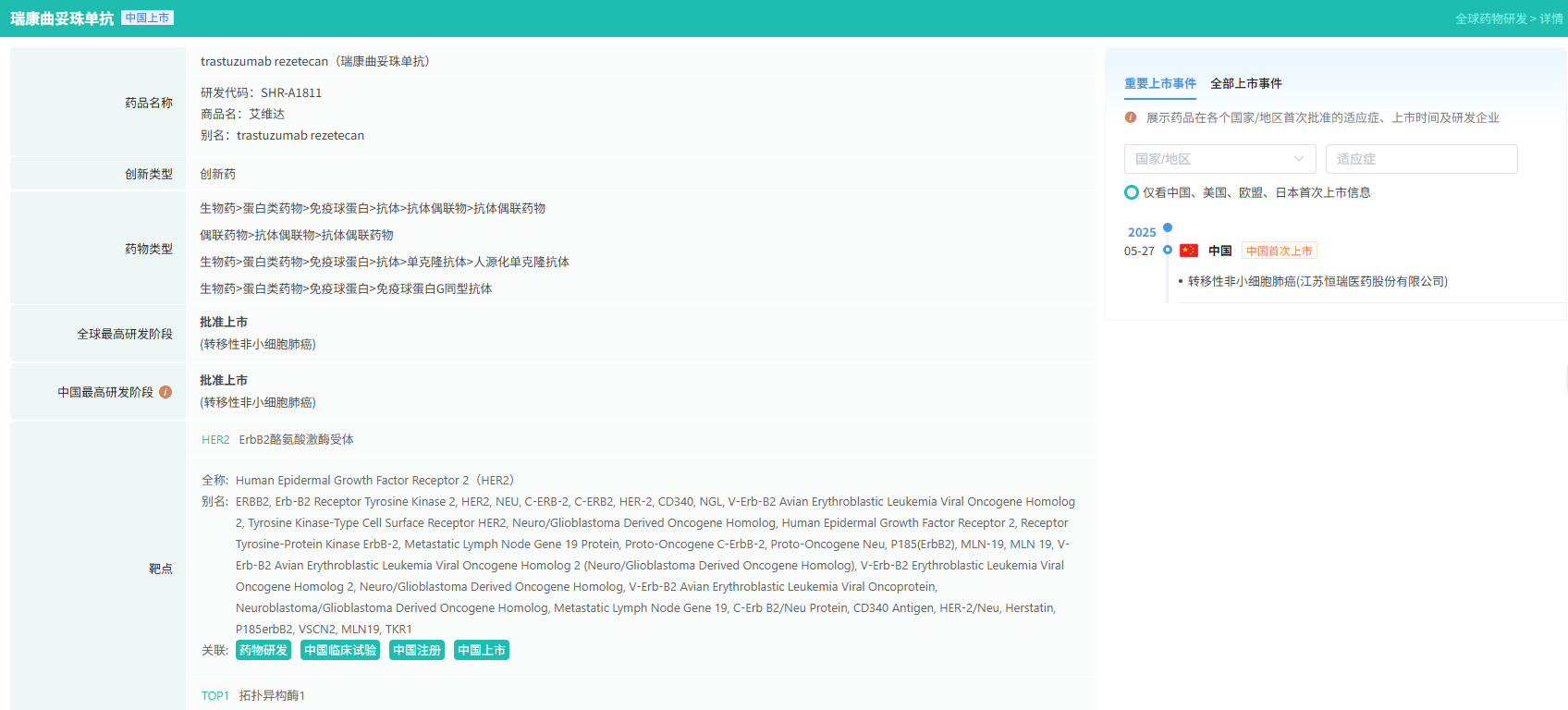
截图来源:摩熵医药数据库(全球药物研发数据库)













































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论