一、碱基编辑的精准性突破与递送体系构建
Beam的技术基石是其专有的碱基编辑平台,该技术通过融合CRISPR蛋白与脱氨酶,实现基因组单碱基的精准修改而不引发双链断裂。具体而言,胞嘧啶碱基编辑器(CBE)与腺嘌呤碱基编辑器(ABE)分别利用工程化脱氨酶,将胞嘧啶(C)转化为胸腺嘧啶(T)或腺嘌呤(A)转化为鸟嘌呤(G),配合失活的CRISPR蛋白(如Cas9 nickase)引导至目标位点,通过单链切口诱导细胞修复机制,实现碱基的定向转换。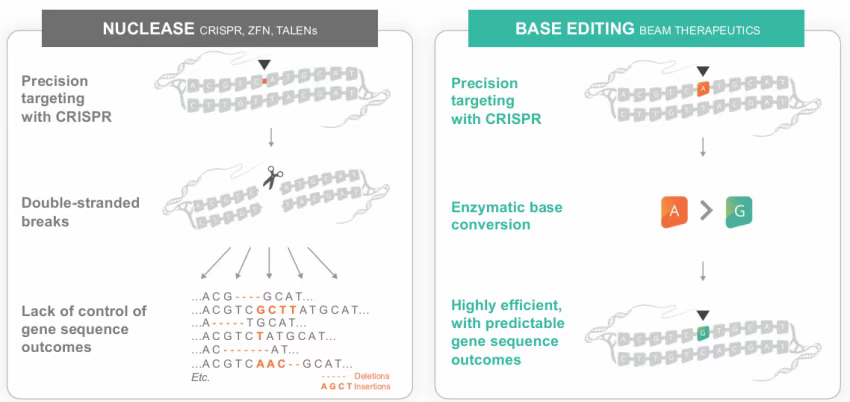
与传统核酸酶编辑(如Cas9)相比,碱基编辑具有多重优势:(1)避免双链断裂相关的基因组不稳定风险,降低染色体易位与细胞凋亡概率;(2)编辑效率可达60%以上,显著高于同源重组介导的精准编辑;(3)可在非分裂细胞中发挥作用,拓展适用组织范围;(4)模块化设计允许通过更换向导RNA快速重定向至不同靶点,提升研发效率。
为实现碱基编辑工具的体内高效递送,Beam构建了离体与体内双轨递送策略。
离体编辑平台:针对血液系统疾病,采用电穿孔技术将碱基编辑组件递送至患者自体造血干细胞(HSC),编辑后回输体内。该策略已在BEAM-101项目中验证,通过编辑HSC中的HBG基因激活胎儿血红蛋白(HbF),缓解镰状细胞贫血症状。
体内递送平台:开发肝靶向脂质纳米颗粒(LNP)系统,用于递送碱基编辑mRNA及gRNA至肝脏。该平台在BEAM-302与BEAM-301中应用,利用LNP的肝细胞靶向特性实现基因突变的原位修复。
此外,Beam通过与Orbital Therapeutics的合作,探索下一代非病毒递送技术,旨在突破肝组织限制,实现更广泛的组织靶向。
二、多元合作模式助力管线推进
01血液系统疾病管线:镰状细胞贫血的治愈希望
BEAM-101是一款自体造血干细胞碱基编辑疗法,通过编辑HBG1/2基因启动子区域,诱导HbF持续表达,抑制镰状血红蛋白(HbS)聚合。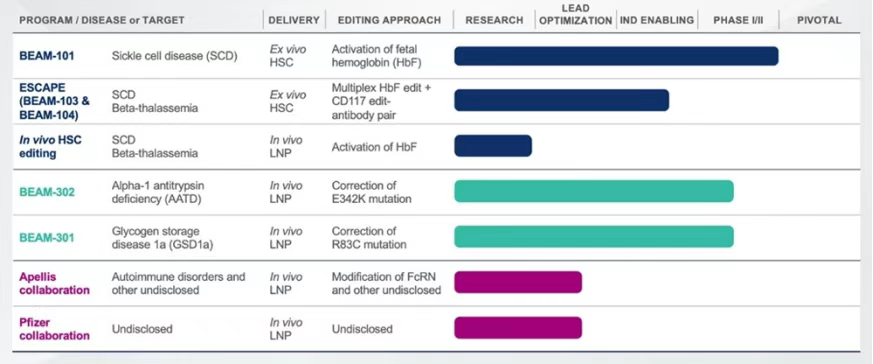
2024年12月公布的临床试验1/2研究(BEACON试验)初步数据显示:(1)7例患者在治疗后实现内源性HbF水平超过60%,HbS水平降至40%以下,且疗效持续至数据截止(随访1-11个月);(2)中性粒细胞与血小板植入中位时间分别为17.1天与19.1天,造血重建效率与传统造血干细胞移植相当;(3)溶血标志物(间接胆红素、LDH等)全部恢复正常,且未报告移植后血管闭塞危象。
BEACON试验的成人组和青少年组的入组工作已经完成,截至2025年6月13日,已有26名患者服用了BEAM-101,预计2025年中期为30名患者用药,并在2025年底分享该试验的其他数据。
02肝脏疾病管线:单剂量治愈遗传代谢病的探索
BEAM-302正在研究用于治疗α-1抗胰蛋白酶缺乏症(AATD)。AATD是一种常染色体隐性遗传病,主要由SERPINA1基因的PiZ突变引起。BEAM-302利用腺嘌呤碱基编辑器(ABE),通过脂质纳米颗粒(LNP)系统将编辑工具递送至肝脏细胞。在肝脏细胞中,ABE能够在DNA水平上对SERPINA1基因的E342K突变位点进行A-to-G的单碱基修复,将突变的Z-AAT基因修正为正常的M-AAT基因。
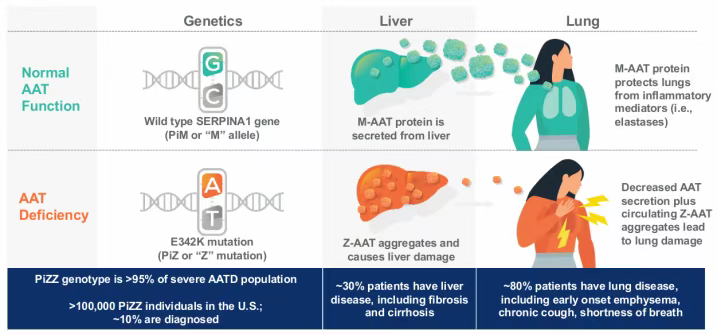
修正后的M-AAT基因能够正常表达具有功能的M-AAT蛋白,而突变的Z-AAT蛋白水平则会显著降低。在已公布的临床试验数据中,单剂BEAM-302在最高剂量组(60mg)使患者体内突变的Z-AAT蛋白水平降低79%。
经过基因修正后,肝脏能够产生足够的功能性M-AAT蛋白并释放到血液中,从而提高患者体内功能性AAT的水平。数据显示,在60mg剂量组,患者的总AAT水平从基线的4.4µM增加到28天时的12.4µM,且这些增加的AAT具有正常的生理功能,能够有效抑制中性粒细胞弹性蛋白酶的活性。
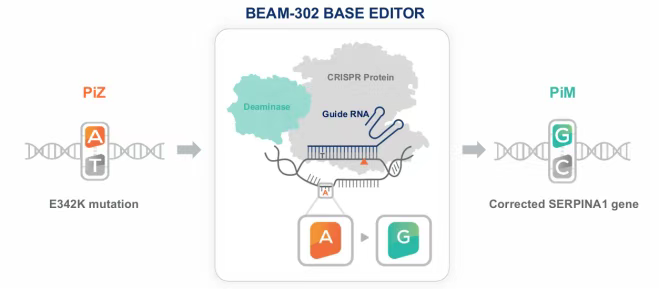
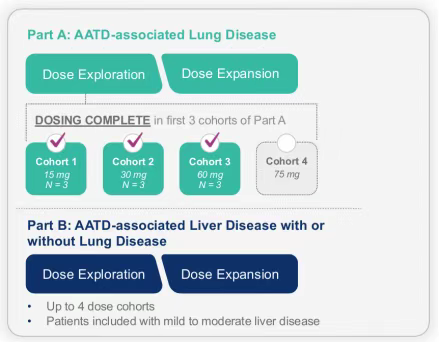
正在进行的BEAM-302的临床试验1/2期研究的初步安全性和疗效数据良好,证实了BEAM-302作为AATD潜在治疗方法和体内碱基编辑的临床概念。研究A部分前三个单剂量组的初步结果表明,BEAM-302的耐受性良好,单剂量BEAM-302可使致病突变得到持久、剂量依赖性的纠正,60mg剂量组的总AAT蛋白水平高于治疗阈值。Beam已经开始了A部分第四组的给药,对75mgBEAM-302进行评估,预计将在2025年下半年的医学会议上报告最新数据。此外,公司还计划在2025年下半年对B部分的首例患者进行用药,该部分将包括轻度至中度肝病的AATD患者。
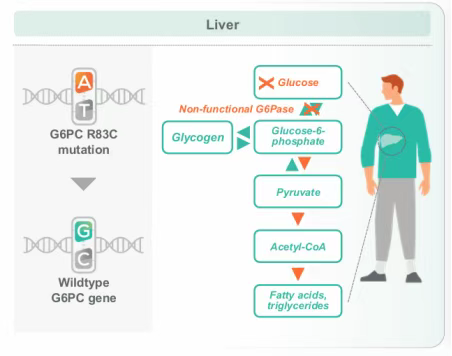
BEAM-301是一种针对肝脏的LNP制剂,携带碱基编辑工具,能够特异性靶向肝脏细胞,精准地对G6PC基因中的R83C突变位点进行修正;修正后的G6PC基因可正常表达葡萄糖-6-磷酸酶,从而确保肝脏正常合成和分泌葡萄糖,恢复血糖的正常代谢,有望从根本上治疗GSD1a(糖原贮积病1a型)。
BEAM-301目前正在进行临床试验1/2期研究,以评估其在GSD1a患者中的安全性、耐受性、药效学、药代动力学和疗效。2025年第一季度,在美国进行的临床试验1/2期研究已经为首例患者用药。
Beam的管线布局还包括基于碱基编辑的多重编辑技术,如Engineered Stem Cell Antibody Paired Evasion(ESCAPE)平台,通过编辑HSC中的CD117基因使其逃避抗体介导的清除,结合抗体预处理替代传统化疗,降低移植毒性。
此外,Beam通过多元化合作模式加速技术转化与市场拓展。例如,与辉瑞达成研究合作,聚焦肝脏、肌肉与中枢神经系统罕见病的体内碱基编辑项目;与Apellis Pharmaceuticals合作进行补体系统相关疾病(如眼部、肝脏疾病)的研究;还与Verve Therapeutics的合作,授权其使用碱基编辑技术开发心血管疾病疗法,后该合作权益转让给礼来(文末会详细介绍)。这些合作不仅为Beam带来资金支持,更借助合作伙伴的临床开发与商业化能力,加速了公司管线的推进。
三、现金储备充沛
2024年度,Beam研发费用为3.676亿美元,一般和行政支出为1.115亿美元,全年净亏损为3.767亿美元,合每股亏损4.58美元。
2025年第一季度研发费用为9880万美元,上年同期8480万美元;一般及行政费用为2790万美元,上年同期为2670万美元;净亏损1.093亿美元,合每股亏损1.24美元,2024年第一季度净亏损为9870万美元,合每股亏损1.21美元。
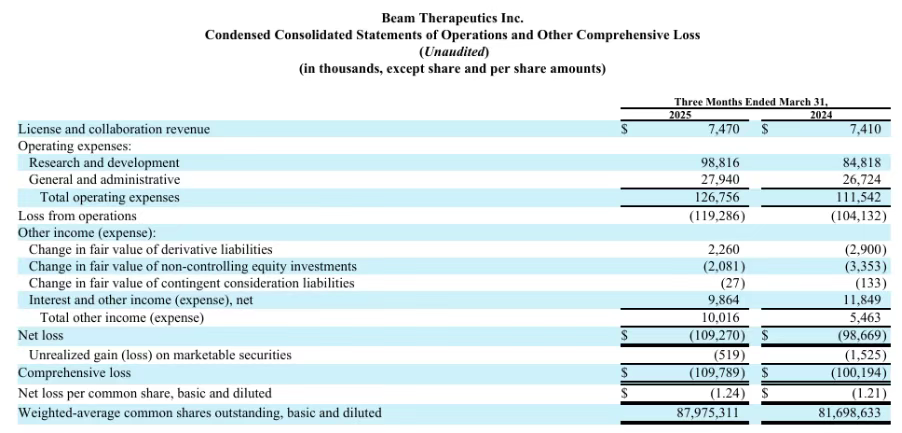
截至2025年3月31日,公司的现金、现金等价物和有价证券为12亿美元,预计将为公司预期运营支出和资本支出需求提供资金至2028年。
四、与礼来或有后续“羁绊”
2025年6月17日,礼来宣布收购Verve Therapeutics,Beam将其与Verve Therapeutics合作的心血管疾病碱基编辑项目(包括PCSK9、ANGPTL3及未公开靶点)的共同开发与商业化选择权转让给礼来。礼来支付2亿美元预付款和5000万美元股权投资,并承诺最高3.5亿美元里程碑付款(累计潜在6亿美元),交易总额为当时基因编辑领域最大单笔交易之一。礼来获得独家选择权,可在临床试验1/2研究后决定是否共同开发,若选择,则承担65%的成本并分享65%的利润(Beam占35%)。
Beam借此剥离非核心心血管项目,集中资源于自主管线,符合其2023年10月的“战略重组”计划。礼来通过此次合作深化基因编辑布局,获得Verve的PCSK9靶向疗法VERVE-101及ANGPTL3项目的权益,旨在开发 “一次性治愈心血管疾病” 的疗法。礼来明确表示该项合作是对碱基编辑技术潜力的认可,并计划利用Beam的平台扩展适应症。
短期来看,Beam与礼来仍以合作授权为主,无明确收购计划。但是长远来看,若BEAM-101成功获批或BEAM-302展现治愈潜力,礼来可能以战略收购整合Beam的技术平台,尤其在心血管领域的协同。此时,Beam的估值将取决于临床数据,收购概率会随管线成熟度上升。
参考资料:
NMPA/CDE
摩熵医药数据库,https://pharma.bcpmdata.com/
FDA/EMA/PMDA;
相关公司公开披露(除标注外,正文图片均来自企业官网)
https://beamtx.com/
https://beamtx.com/pipeline/
https://investors.beamtx.com/
https://investors.beamtx.com/static-files/a2f39903-04a5-4d95-8270-6ca6d5c47630
https://mp.weixin.qq.com/s/J-r349EIuNpkjqhQ7_FcKg
https://www.genengnews.com/topics/genome-editing/all-about-that-base-editing/
https://www.36kr.com/
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

https://www.stocktitan.net/news/BEAM/beam-therapeutics-presents-additional-data-for-beam-302-in-alpha-1-fser0l5rtg88.html
https://www.lilly.com/news/press-releases;等等。









































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)













 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论