
1.引言
氢溴酸伏硫西汀片是由丹麦灵北制药(Lundbeck)和日本武田制药(Takeda)联合研发的,目前已经在美国、日本及欧盟多国上市。2013年9月被FDA批准。原研氢溴酸伏硫西汀片已于2017年11月21日在国内上市,规格:5mg、10mg、20mg,产地:丹麦。
氢溴酸伏硫西汀抗抑郁的作用机制尚不完全明确,普遍认为与抑制5-羟色胺(5-HT)再摄取,增强中枢神经系统的5-羟色胺活性有关。氢溴酸伏硫西汀还具有其他一些活性,包括5-HT受体拮抗作用和5-HT受体激动作用,这些活性在氢溴酸伏硫西汀抗抑郁中的作用尚不确定。
2.氢溴酸伏硫西汀
2.1氢溴酸伏硫西汀理化特性
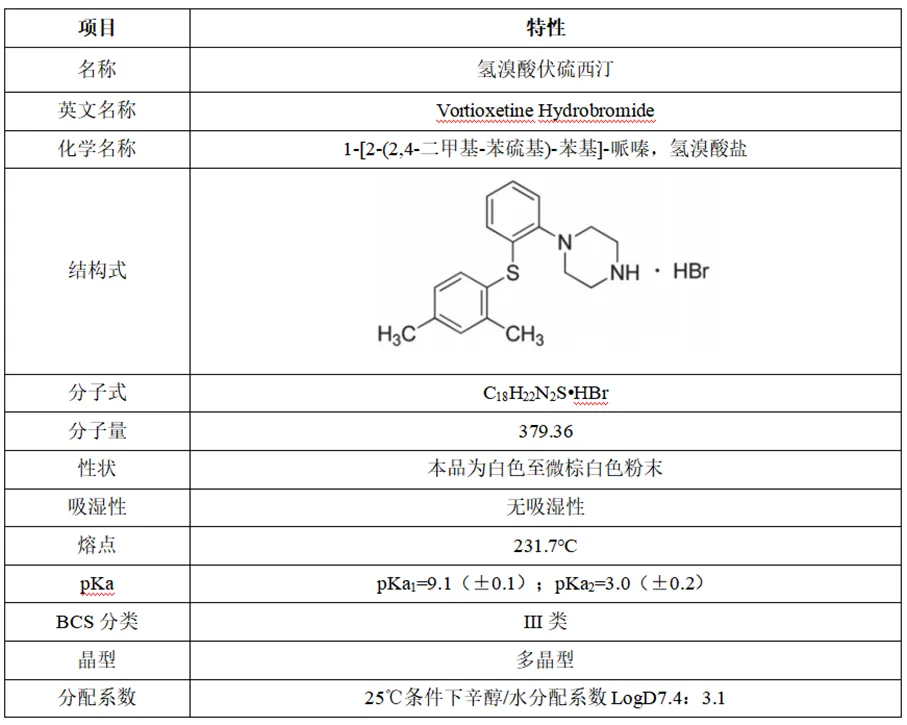
2.2溶解性
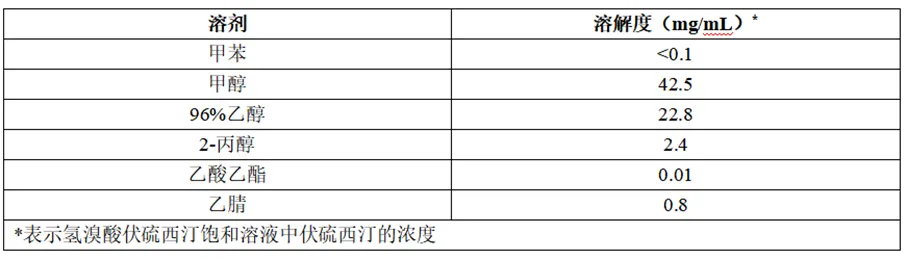
氢溴酸伏硫西汀在各有机溶剂中的溶解度(约22℃)如下:
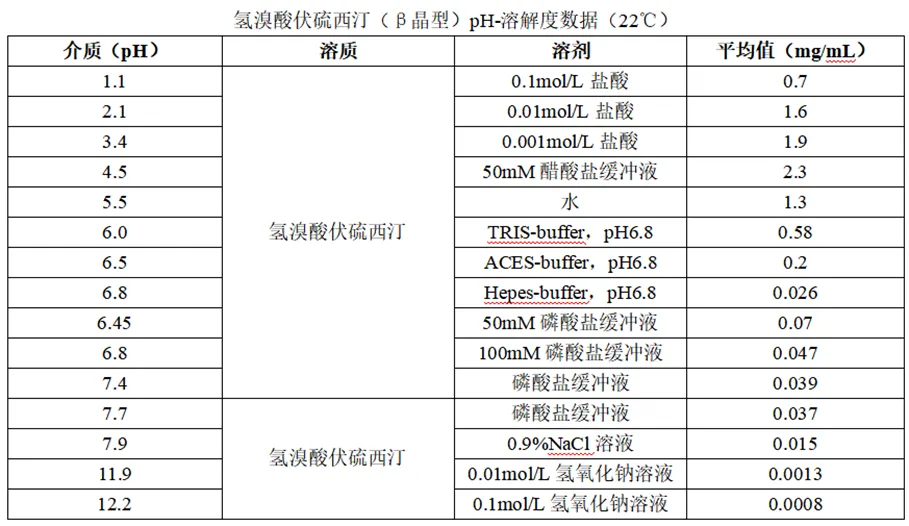
β晶型氢溴酸伏硫西汀在22℃溶剂中的溶解度表明氢溴酸伏硫西汀的pH-溶解度具有明显的pH依赖性(其饱和水溶液pH值约为5.5)。在酸性介质中溶解度较高,pH≤5.5时其溶解度无明显差异。原料药的粒径对药物的溶出速率有影响,经过研究申报人将原料药的粒径(D50)定为30-120μm,在该粒径范围内,未发现粒径对样品关键性质产生影响。
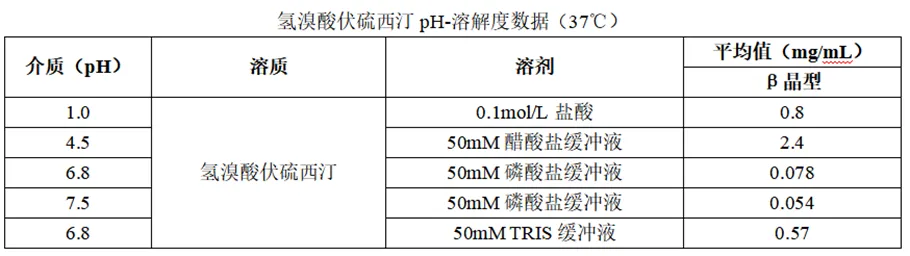
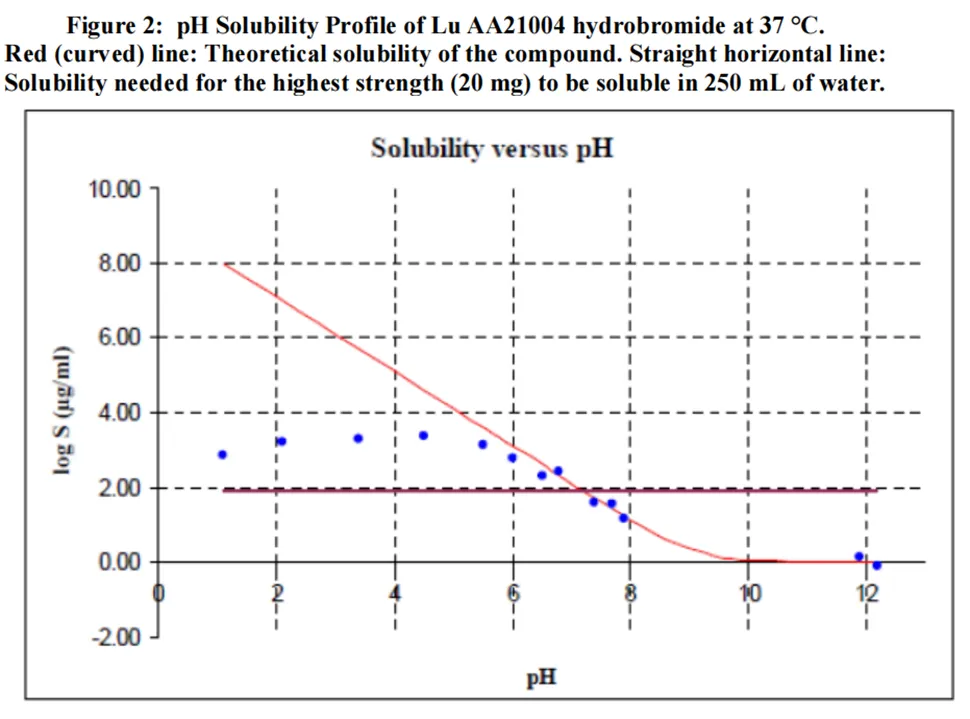
在所有生理相关的pH(pH值低于7.5)下,氢溴酸伏硫西汀均符合BCS定义中高溶解性的定义(最高浓度20mg在250ml水中的溶解度),因为剂量/溶解度比值≤250ml(20mg/0.08mg/ml=250mg),证明其为高溶解性药物。
渗透性:体内质量平衡研究显示尿液中回收了59%的放射性标记的药物,且绝对生物利用度为75%,因此认为伏硫西汀的表现出中等的渗透性。
基于上述数据,申请人认为伏硫西汀为BCS III类药物。
2.3分配系数及膜渗透性
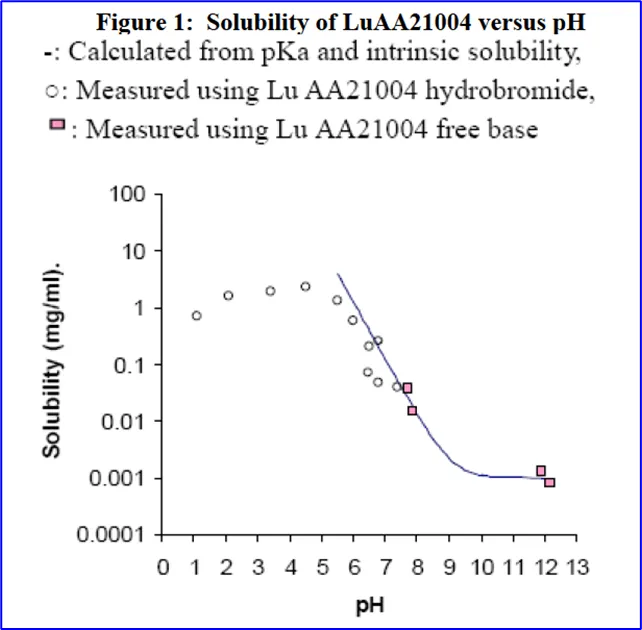
25℃条件下氢溴酸伏硫西汀在正辛醇与各种pH介质中的分配系数变化趋势见下图。
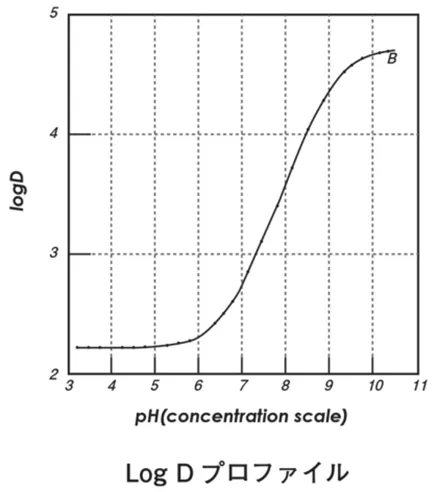
伏硫西汀是一种弱碱性化合物,在接近中性pH条件下pH7.4(与血液pH值相近)的环境中表现出非常令人满意的膜渗透性。相反,在较低的pH值(≤5.5)环境中,由于该化合物的游离碱形式进一步下降,膜渗透性明显下降。因此伏硫西汀在小肠中表现出较好的吸收。
3.氢溴酸伏硫西汀片
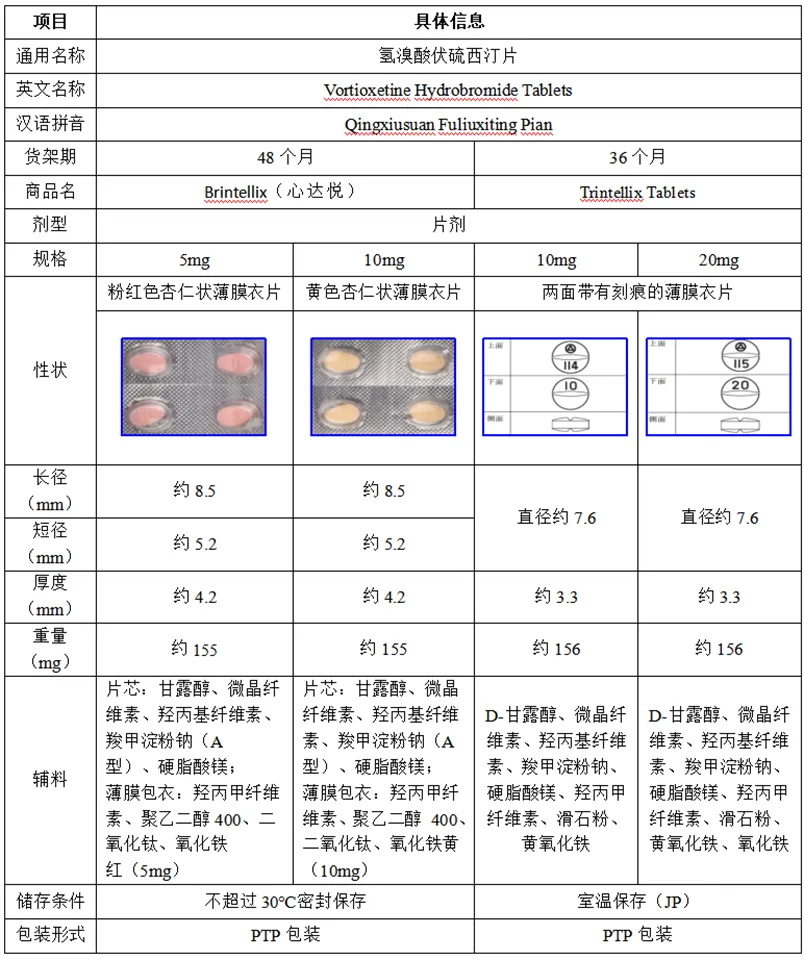
3.1氢溴酸伏硫西汀片参比制剂信息
3.2参比制剂处方组成及生产工艺
伏硫西汀片参比制剂公开的处方组成及石药中奇专利中公布的处方一致,具体见下表:
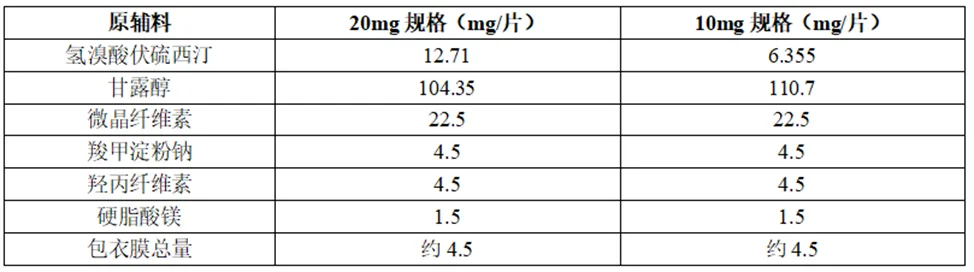
EMA官网公布Brintellix的生产工艺步骤主要包括:混合、流化床制粒、干燥、混合、压片和包衣,因此判断参比制剂的制粒工艺为一步制粒。亦可采用湿法制粒工艺进行产品开发。
具体工艺可参考石药集团中奇制药技术(石家庄)有限公司专利“一种氢溴酸伏硫西汀片的制备方法”(CN112006995A)中的工艺步骤,并在此基础上结合API和辅料性质进行工艺调整。专利中的制备工艺如下:
生产工艺:
(1)称取内加原辅料氢溴酸伏硫西汀、甘露醇、微晶纤维素和羧甲淀粉钠。
(2)6W/W%羟丙纤维素的水溶液配制。
(3)将内加原辅料加入流化床中,设置进风温度60℃,风量500m³/h,出口空气温度26℃,雾化压力3bar,通过蠕动泵将6%的HPC水溶液喷入流化床中,控制喷液速度500~700g/min,喷完液后,干燥。
(4)将所得颗粒过1.5mm筛网进行整粒,并加入外加辅料微晶纤维素,混合10min(10rpm/min)。加入外加辅料硬脂酸镁,混合5min(10rpm/min)。
(5)将步骤(4)所得混合物进行压片,得到底片。
(6)包衣。具体包衣工艺不详,本品为速释制剂,因此包衣工艺可参考常规速释制剂包衣参数。结合本品参比制剂药动学性质评估,包衣工艺不会影响体内药代动力学。
3.3溶出曲线与药代动力学分析
3.3.1参比制剂溶出曲线
根据参比制剂生物药剂学回顾可知氢溴酸伏硫西汀片参比制剂的溶出方法为:桨法,50rpm;溶出介质:0.1N盐酸(900ml,37℃),30min时溶出度不低于标示量的85%(Q=85%)。FDA披露的氢溴酸伏硫西汀片的溶出曲线,具体溶出曲线见下图。
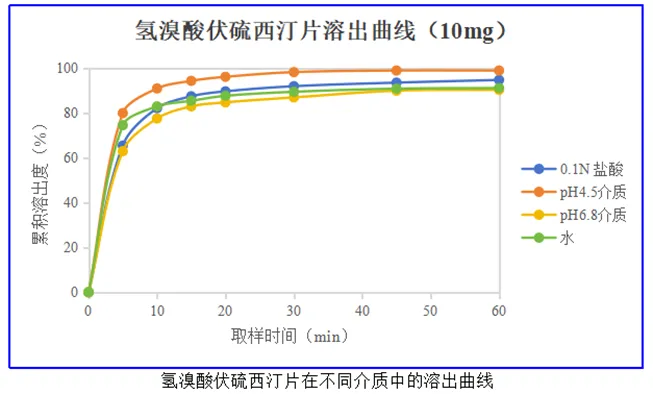
氢溴酸伏硫西汀片参比制剂溶出曲线结果显示,氢溴酸伏硫西汀片在pH1.0、pH4.5和pH6.8及水4种溶出介质中均为极快速溶出(15分钟的溶出量高于85%)。
3.3.2组合包装VOQUEZNA DUAL PAK溶出曲线
FDA披露氢溴酸伏硫西汀片的溶出方法:桨法,50rpm;溶出介质:0.1N盐酸(900ml,37℃),30min时溶出度不低于标示量的85%(Q=85%)。该方法能够区分典型批次与界限批,具有一定的区分力。
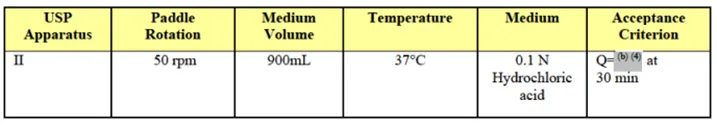
3.3.3崩解性、混悬液的饲管通过性及溶出曲线研究:
氢溴酸伏硫西汀片IF文件中披露了临床用药决策支持信息。
(1)粉碎
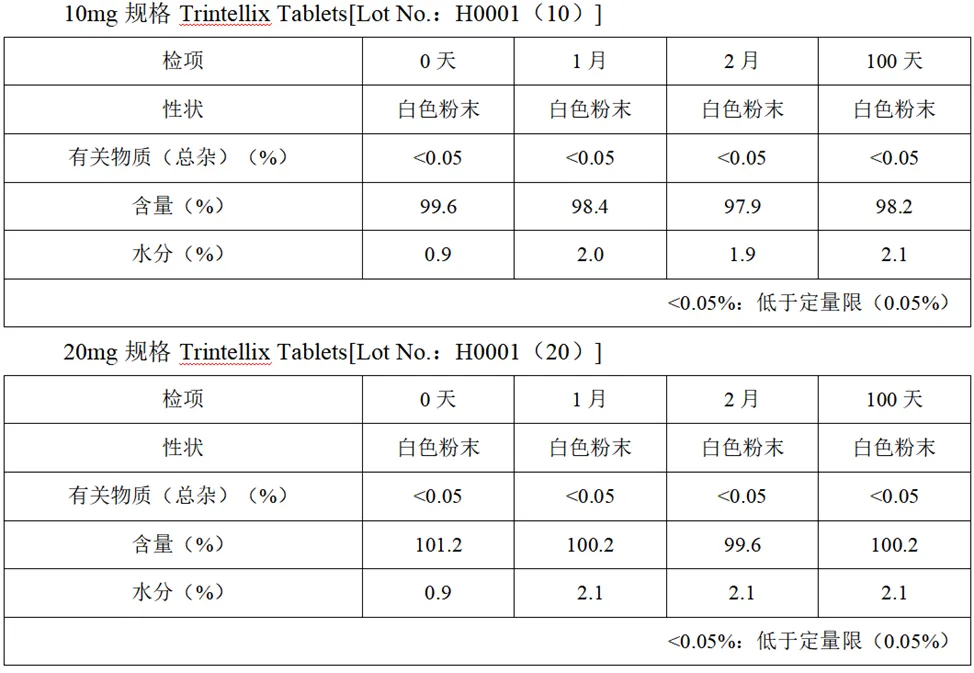
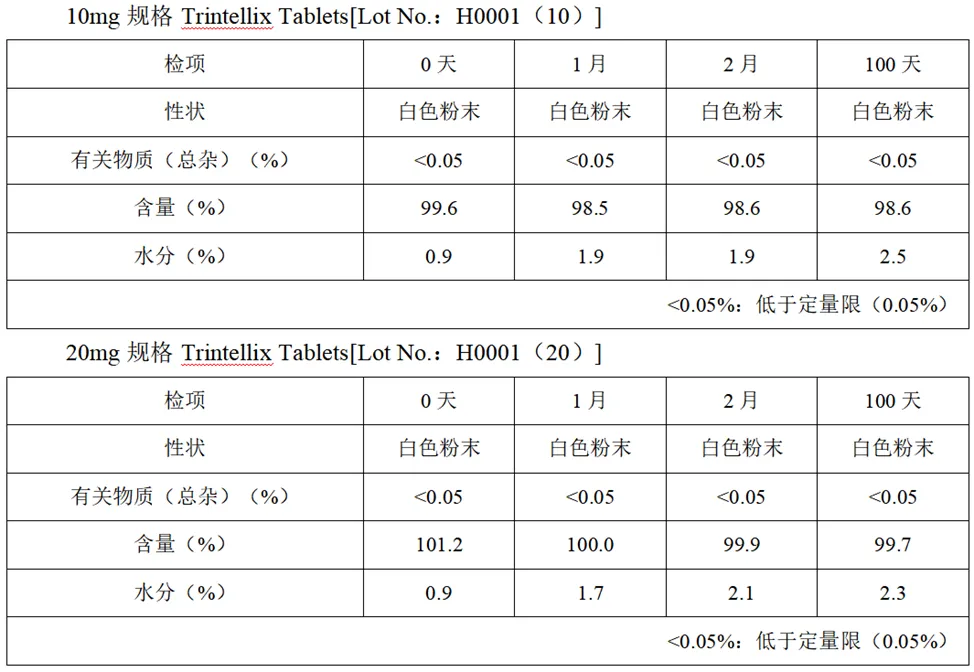
粉碎后稳定性
10mg、20mg规格Trintellix Tablets粉碎后储存条件:25℃/75%RH、内部散射光、玻璃容器、开盖和0℃、遮光、玻璃容器、密封,稳定性如下:
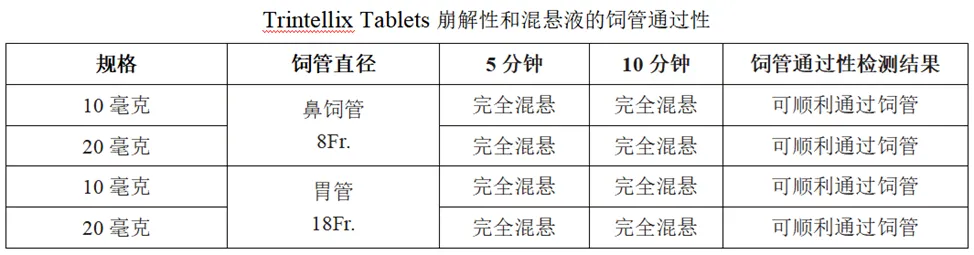
崩解性、混悬液的饲管通过性
混悬条件:将1片10mg或20mg的Trintellix Tablets置于20mL55℃的热水中,37℃条件下静置。5分钟和10分钟后,轻摇并观察崩解情况,然后采用注射器检测饲管通过性。
崩解方式:破坏包衣膜。结果:两个规格的参比制剂均在10分钟后完全崩解,并能顺利通过饲管给药。
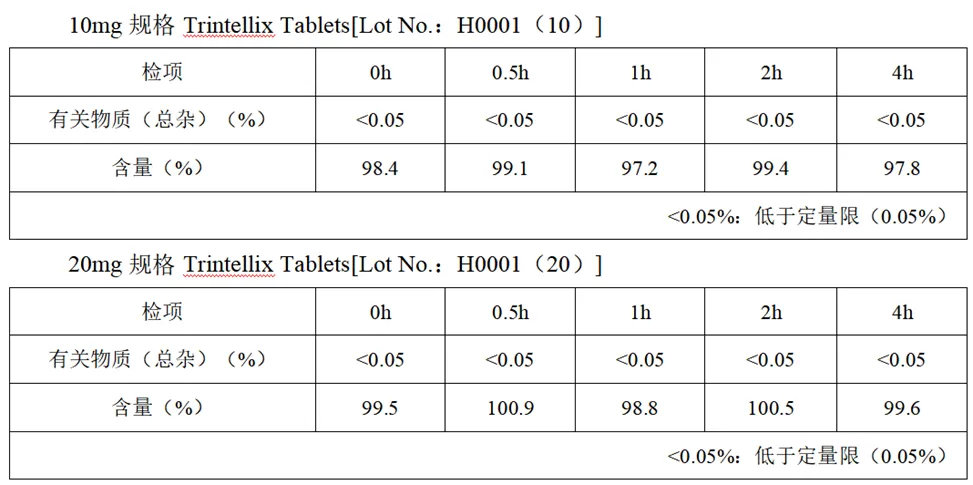
混悬液稳定性
混悬条件:将1片10mg或20mg的Trintellix Tablets置于20mL55℃的热水中,37℃条件下静置。5分钟和10分钟后,轻摇并观察崩解情况,然后将混悬液置于25℃条件下储存。
结果:4小时内有关物质、含量没有发生明显变化。
将崩解后的混悬液全量转移至溶出杯中,考察了混悬液的溶出曲线(0.1N HCl),结果见下表。
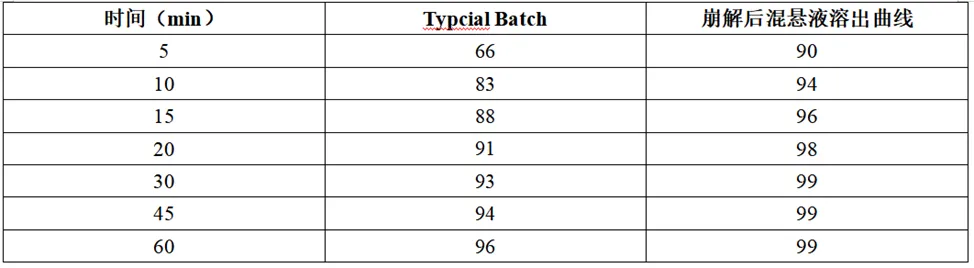
结果表明,崩解后的混悬液溶出速率较速释片剂(Trintellix Tablets)明显增加。5min时的溶出量相差较大,两个溶出数据相差24%。
以上信息是供医护人员考虑临床应用的参考信息,推断崩解后会溶出速率会提高,可采用饲管给药,推断崩解后给药可能不会影响体内PK或安全性。
晶型
氢溴酸伏硫西汀参比制剂中所用原料药的晶型为β晶型,其晶型专利将与2027年到期,为规避专利提前上市,有些企业可能采用的α晶型的原料药进行产品开发,因此需要评估不同晶型的原料药的体外溶解度、溶解速率差异及自制产品的溶出差异。由数据(下表)可知,α晶型和β晶型的伏硫西汀体外溶解度没有差异。
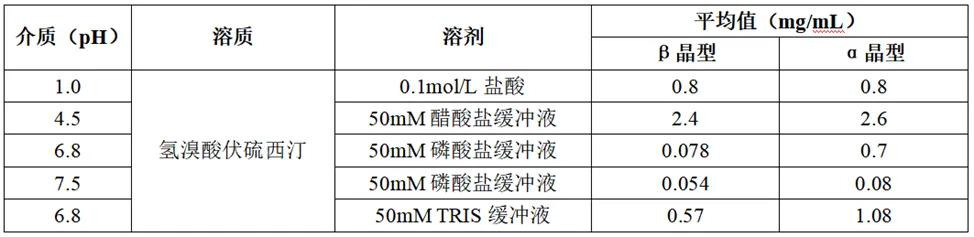
采用转盘法测定了α晶型和β晶型的氢溴酸伏硫西汀的体外固有溶出,α晶型的氢溴酸伏硫西汀固有溶出速率在1~1.3mg·cm-2·min-1,β晶型的氢溴酸伏硫西汀固有溶出速率在1~1.5mg·cm-2·min-1,表明两种晶型的原料药体外溶解速率没有差异。
采用两种晶型的原料药制备速释片,并测定其在0.1N盐酸介质中的溶出曲线。
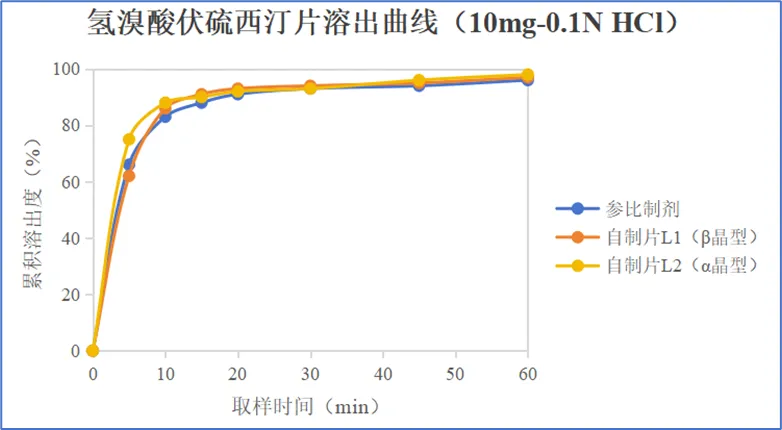
结果表明,采用两种晶型制备的速释片,溶出曲线无明显差异,晶型对溶出曲线无影响。两批自制片5min时的溶出量相差13%,这归因于小试样品包衣增重的差异以及片芯崩解时限的差异,而非溶出速率的差异。另外结合伏硫西汀在人体内的药代动力学性质分析,5min时的溶出差异不会影响生物等效性。因此,采用α晶型的氢溴酸伏硫西汀进行产品开发,不会影响体内药代动力学,BE风险较低。
3.3.4伏硫西汀口服滴剂溶出曲线
除了氢溴酸伏硫西汀片之外,灵北制药还开发了伏硫西汀(伏硫西汀乳酸盐,提高溶解度)口服滴剂(20mg/ml)。具体信息如下:
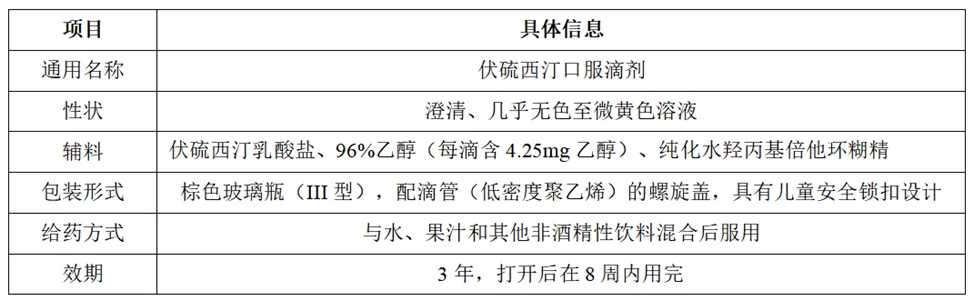
生产工艺主要包括三个工序:溶液配制、过滤和灌装。
补充研究了伏硫西汀口服滴剂(溶液)溶出曲线(0.1N HCl),溶出曲线对比结果见下表。
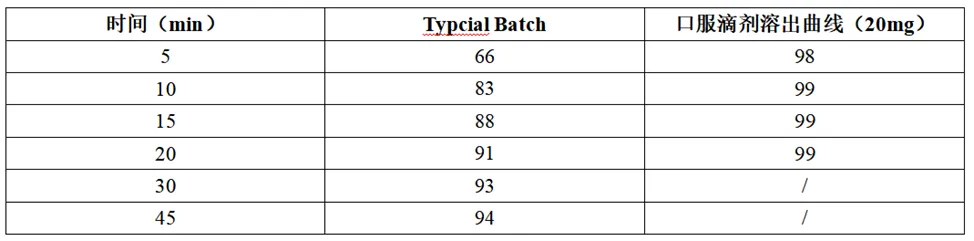
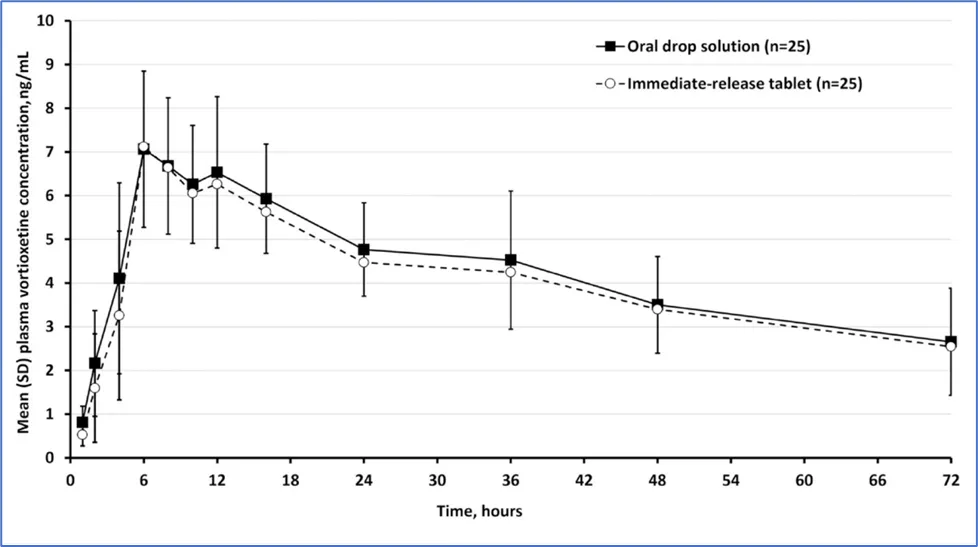

数据表明,伏硫西汀口服滴剂(溶液)与伏硫西汀速释片在英国人体内生物等效,可知制剂中辅料种类、用量不同不会影响伏硫西汀的药代动力学,两制剂的达峰时间均在6-16h小时,吸收速率相对于溶出速率比较缓慢。
3.3.5 Q值对生物等效性的支持
Brintellix Tablets审评信息披露该品种30min时的Q值是合理的,并有生物等效性数据对该标准的制定提供了支持。Side-Batch溶出曲线与Typcial Batch溶出曲线不相似,两制剂生物等效。

3.3.6药代动力学分析
3.3.6.1 10mg规格单次给药后药代动力学
IF文件披露日本健康受试者空腹单剂量口服10mg规格(半片)后,体内伏硫西汀药代动力学结果如下:

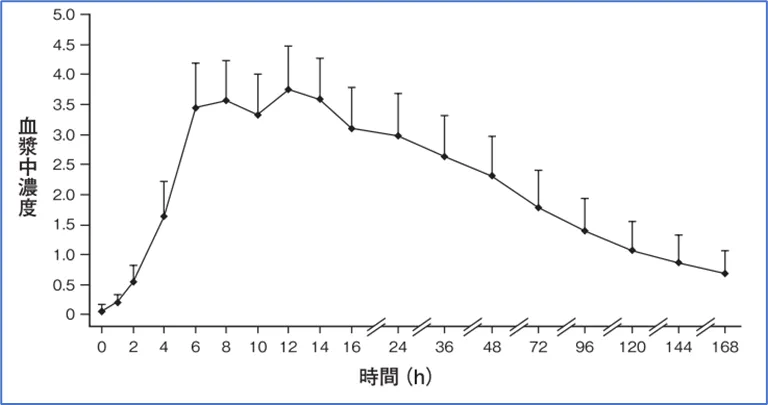
由数据可知,伏硫西汀在亚洲人群、欧洲人群中的药代动力学基本一致,其10mg和20mg规格呈线性关系。人种差异不会影响伏硫西汀的药代动力学。且食物效应不会影响伏硫西汀的药代动力学。
3.3.6.2国内10mg规格片剂体内BE结果
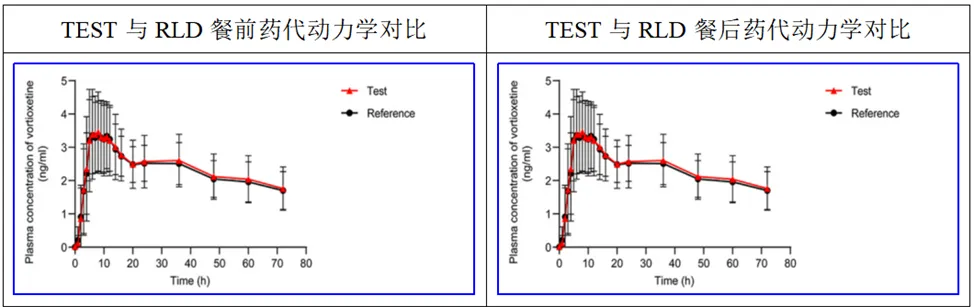
按照以上评估,氢溴酸伏硫西汀体内吸收的限速步骤是渗透,而非溶出,因此该品种的BE风险较低。石药集团欧意药业有限公司的氢硫酸伏硫西汀片的BE研究结果也证明了这一点:餐前、餐后药代动力学曲线几乎与参比制剂完全一致,Cmax和AUC的比值在98%-102%之间,变异系数在6%-11%之间,为低变异品种。餐前和餐后Tmax、Cmax无明显差异,药代动力学参数一致。
3.3.6溶出曲线的安全空间
基于对药动学、片剂崩解后溶出曲线、口服滴液的溶出曲线及溶出度Q值制定与体内BE的研究结果进行讨论和分析,确定了氢溴酸伏硫西汀片溶出曲线的安全空间。具体空间见下图,安全区间为口服滴剂和Side-Batch溶出曲线之间的区域。
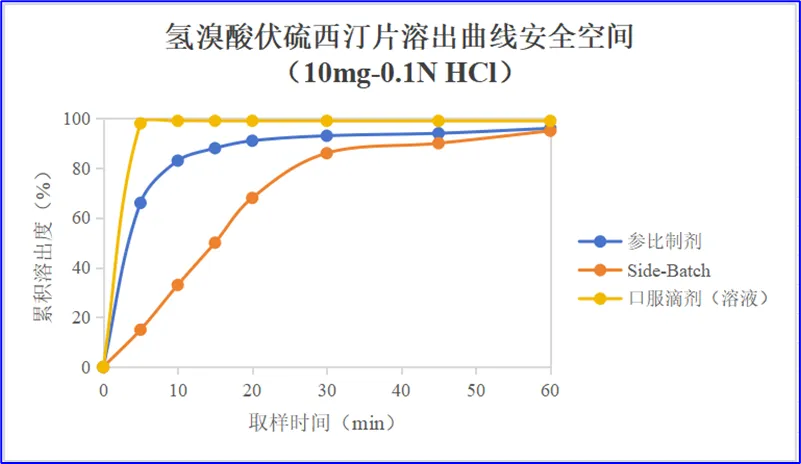
对安全空间的上下限进行汇总,结果如下:
(1)5min取样点溶出范围(15%,98%)
(2)10min取样点溶出范围(33%,99%)
(3)15min取样点溶出范围(50%,99%)
(4)20min取样点溶出范围(68%,99%)
4.讨论
4.1辅料种类
口服滴剂和氢溴酸伏硫西汀片的生物等效性研究结果表明,甘露醇不影响伏硫西汀的药代动力学参数,因此其5mg规格片剂(和10mg规格等片重,非等比)可以豁免BE,或按照国内的申报要求,可按照等比处方申报。
4.2 BE风险评估
氢溴酸伏硫西汀为BCS III类药物,结合溶出速率和药代动力学结果表明伏硫西汀具有较低的渗透性,人体药代动力学不受晶型和溶出速率的影响。在第3节内容讨论后,分析并建立了氢溴酸伏硫西汀片的生物等效性的溶出曲线安全区间,其溶出曲线可不相似,为降低BE风险,溶出曲线的前15min每个时间点的累积溶出度控制在典型批次(即市售参比制剂)溶出量减去15%和100%之间即可。即收窄后的溶出曲线安全空间如下:
对安全空间的上下限进行汇总,结果如下:
(1)5min取样点溶出范围(51%,100%)
(2)10min取样点溶出范围(68%,100%)
(3)15min取样点溶出范围(73%,100%)
(4)20min取样点溶出范围(86%,100%)
5.总结
在保证原辅料用量、生产工艺与参比制剂相同或相近的前提下,采用有区分力的溶出方法测定溶出曲线,氢溴酸伏硫西汀片仿制药各时间点的累积溶出度在参比制剂溶出曲线安全空间范围内即可保证其与参比制剂生物等效。可不采用f2判断产品的溶出曲线的相似性,该品种仿制药满足以上条件,无需进行预BE研究,可直接开展正式BE。作为乙方,为甲方省下几十万预BE不香吗?作为甲方,为老板省几十万的预BE费用,老板出去也有炫耀的资本,研发人员可能还会喜提几万年终奖。从非审评角度评估,可以直接豁免生物等效性研究。
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论