
7月15日,第二批《调出参比制剂目录》正式稿发布。
早在2023年9月就被纳入征求意见稿的注射用奥沙利铂,终于尘埃落定,确定被调出。

这意味着,注射用奥沙利铂目前已无参比制剂,冻干粉针剂的仿制路径被正式切断。
作为第三代铂类抗肿瘤药,奥沙利铂在国内有两种剂型:真溶液和冻干粉。而它的参比地位,几经反转——
从真溶液替代冻干粉,到原研被剔除出参比,反倒是仿制企业的产品被纳入其中....
一、原研出局,齐鲁上位!
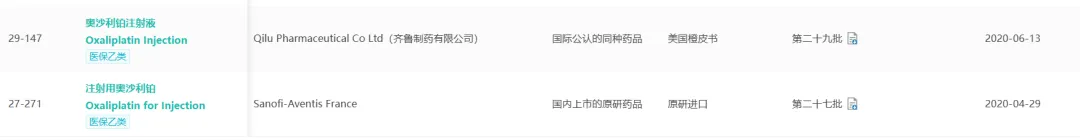
奥沙利铂最早的剂型是冻干粉针剂,由赛诺菲开发,1996年在法国上市,1999年进入中国市场,早期国内上市企业众多,包括奥赛康、恒瑞、扬子江等。此后多年,冻干粉一直是国内主流剂型。
2005年,赛诺菲又在美国上市了溶液型奥沙利铂注射液,但这一剂型却始终未进入国内。
2020年,赛诺菲的冻干粉被列为参比。同时一个月后,真溶液也公布了参比,但却并非是赛诺菲的原研产品,而是齐鲁制药在2016年美国上市的仿制产品。
原研没进,仿制进了。给出的理由也很明确:赛诺菲的奥沙利铂注射液灭菌方式不符合《化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)》,不具备参比资格。
参比制剂的地位从不是唯“原研”论,而是要看具不具备参比地位。对奥沙利铂注射液来说,原研被排除,国产仿制留下。
齐鲁制药的产品凭什么?它较原研有什么改进?
据齐鲁官方披露,其奥沙利铂注射液采用的是终端高温灭菌,而国家药监局在《化学药品注射剂基本技术要求》和《灭菌/无菌工艺验证指导原则》中均明确指出,注射剂应首选高温灭菌工艺,无菌保证水平更高;对于不能耐受终端灭菌工艺的,可以考虑采用过滤除菌或无菌生产工艺。
推测核心差异就在于是否终端灭菌,齐鲁是对原研进行了改进的,并非原样仿制。
而到了2023年9月,赛诺菲的冻干粉又被列入了参比调出目录意见稿,CDE同时明确,奥沙利铂注射剂的参比应首选终端灭菌工艺的注射液,也就是奥沙利铂注射液。
昨天正式发布公告,更是进一步肯定了齐鲁仿制奥沙利铂注射液的参比地位。
二、趋势早有预兆!
其实,奥沙利铂真溶液取代冻干粉的趋势早就有了。
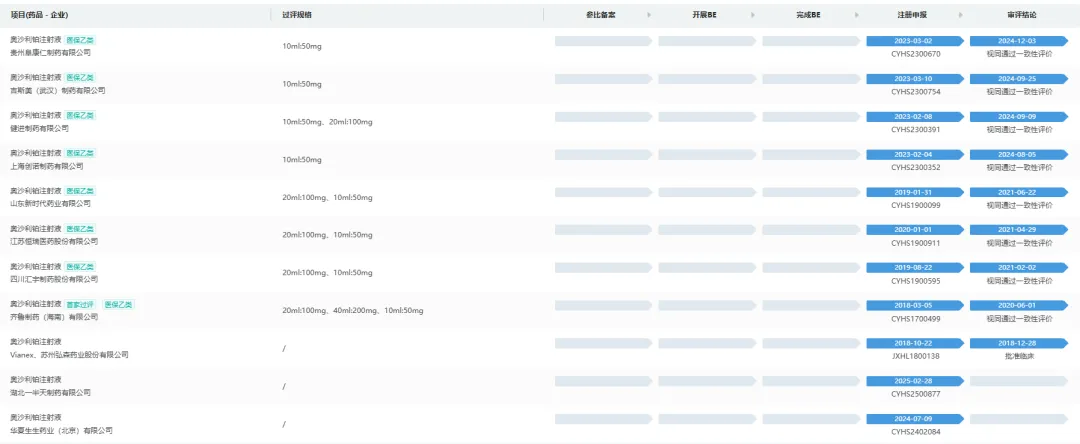
首先从仿制情况来分析,冻干粉仅有三家企业仿制,恒瑞和扬子江在被驳回后便搁置了一致性评价事宜。

反观注射液,申报企业明显更多,且有恒瑞、汇宇等头部企业均有参与,顺利过评的企业也较多,推进节奏远快于冻干粉。
再从市场端来看,注射用奥沙利铂市场不小,2021年前一度突破30亿元,原研赛诺菲占比超90%。
直至2021年奥沙利铂注射剂被纳入第五批国采,冻干粉由赛诺菲独家中标,这也是少有的原研企业中标国采的品种。
但集采带来的价格压缩,依旧使得市场不可避免的下降。随着第五批国采协议期在2024年到期,冻干粉未续标,不再受集采影响,市场仅剩下了15亿,赛诺菲依旧占90%市场。
































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)













 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论