
据不完全统计,2025年1-9月已有16款新药被FDA拒批,涉及到肿瘤、心脏疾病、呼吸系统疾病、眼科疾病和肾脏疾病等,被拒理由绝大多数集中于临床疗效和有效性证据不足问题上,此外CMC问题和第三方问题成为FDA拒绝批准的重要因素。小编将这些被拒批新药总结如下:
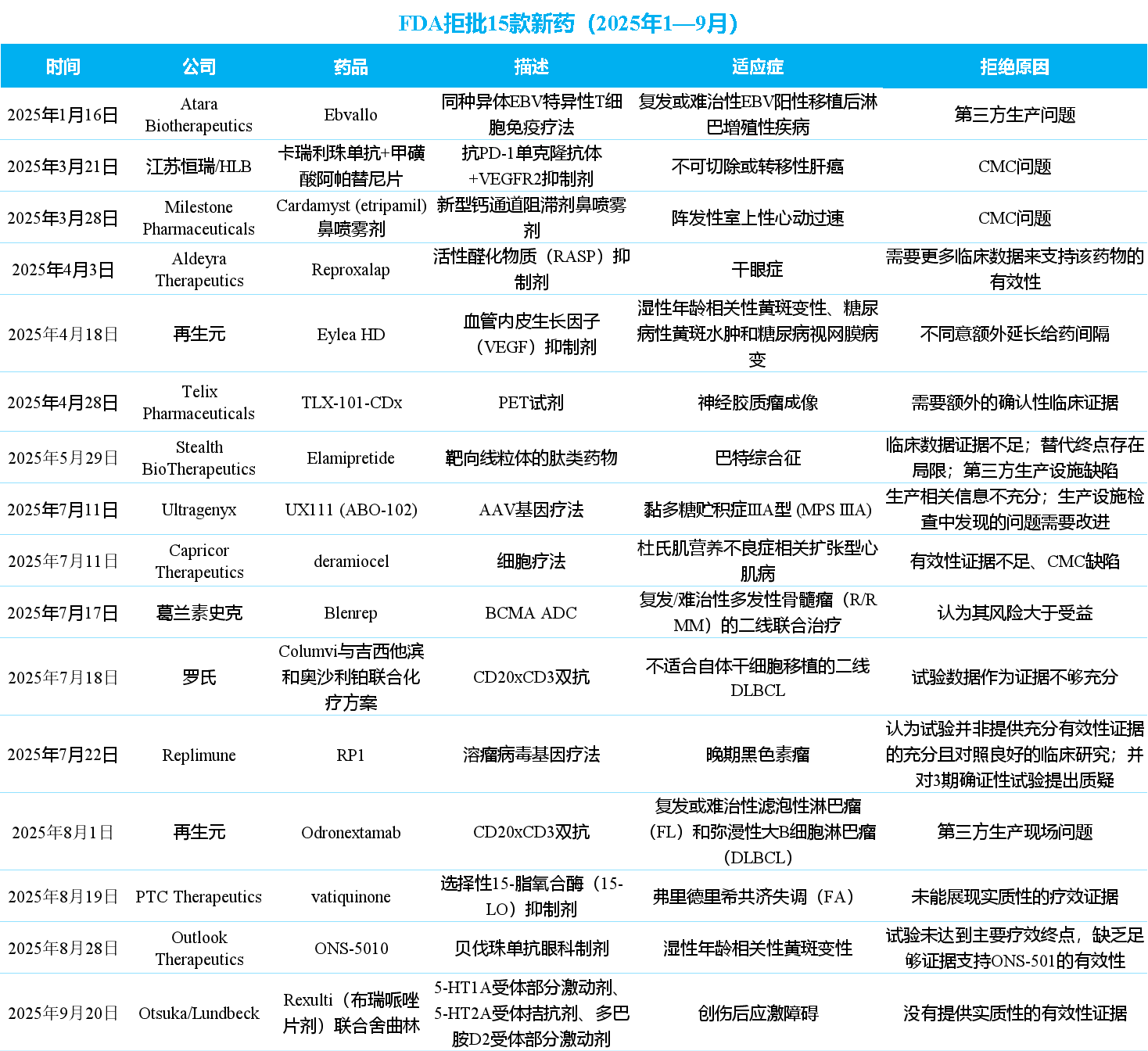
被拒原因一:临床数据与试验设计问题(11款药物)
1. Aldeyra Therapeutics——Reproxalap
4月3日,美国FDA再次驳回了Aldeyra Therapeutics在研干眼症药物 Reproxalap 的新药上市申请 (NDA)。FDA明确指出,需要更多临床数据来支持该药物的有效性,要求Aldeyra至少再完成一项充分且良好对照的临床试验 ,以确保reproxalap在改善干眼症相关眼部症状方面的疗效。FDA明确的关注有包括治疗臂间基线评分差异在内的方法学相关问题对结果解释等。
2. 再生元——EYLEA HD®(阿柏西普8mg注射液)
4月18日,FDA已向再生元发出了完全回复信函(CRL),拒绝了其将 EYLEA HD®(阿柏西普8mg注射液) 的给药间隔从最长16周延长至24周的sBLA。FDA不同意再生元关于增加额外延长给药间隔的提议,但并未提供进一步的解释。再生元表示,监管机构并未指出任何安全性或有效性问题。Regeneron正在评估FDA的决定,并将在适当的时候确定未来的行动方案。
3. Telix Pharmaceuticals——TLX-101-CDx
4月28日,FDA向Telix Pharmaceuticals发出完整回应函(CRL),指出 TLX-101-CDx 的上市申请(NDA)需要额外的确认性临床证据,以支持其用于神经胶质瘤成像的适应症。Telix表示有几种方法可以解决 CRL 问题,包括重新分析现有(未公开)数据,或开展额外的临床试验。
4. Stealth BioTherapeutics——elamipretide
5月29日,Stealth BioTherapeutics宣布FDA拒绝了其针对靶向线粒体的肽类药物 elamipretide 用于治疗Barth综合征的上市申请,但为加速审批设定了路径。FDA同意将SPIBA-201研究中通过手持式测力计评估的膝伸肌肌力作为潜在的中间临床终点,以支持加速批准。FDA在CRL中指出,Stealth提交的SPIBA-201研究未能支持Elamipretide的有效性获得传统或加速批准。FDA认为替代终点仍存在重大局限,无法支持加速批准。除临床数据外,FDA在CRL中还提到了对第三方生产设施进行的cGMP检查(并非针对该药物的批准前检查)中发现的问题。检查结果显示该设施存在多项缺陷,需在提交完整回复前向FDA提供满意的整改回应。
5. Capricor Therapeutics——Deramiocel
7月11日,FDA驳回了Capricor Therapeutics创新细胞疗法 Deramiocel 治疗杜氏肌营养不良症(DMD)相关心肌病的生物制品许可申请(BLA)。FDA 认为现有提交的数据尚不足以构成证明疗效所需的“实质性证据”,要求 Capricor 提供更多临床数据支持。此外,CRL还提及该疗法在CMC方面存在某些缺陷。对此,Capricor反驳称早已在之前的沟通中解决了这些问题,只是由于CRL发布的时间问题,FDA未能审查相关提交材料。
6. 葛兰素史克——Blenrep
7月17日,葛兰素史克(GSK)宣布FDA肿瘤药物咨询委员会(ODAC)以5:3的投票结果反对其BCMA ADC新药 Blenrep 用于复发/难治性多发性骨髓瘤(R/R MM)的二线联合治疗,理由是认为其风险大于受益。ODAC指出,DREAMM-8未达到预设的OS关键次要终点,且两项试验入组人群中美国患者入组率低(每项研究中低于 5%),质疑结果对美国人群的适用性。此外,FDA指出在葛兰素史克两项3期临床试验中观察到的“眼部毒性发生率很高”。FDA还指出,在DREAMM-7和DREAMM-8两项试验中,Blenrep的剂量设计存在问题。试验中大多数患者在治疗第三个周期时已无法维持最初的计划剂量,需要频繁调整剂量。而这可能进一步影响了药物的疗效和耐受性。
7. 罗氏(基因泰克)—— Columvi 联合 吉西他滨 和 奥沙利铂(GemOx)
7月18日,罗氏及其子公司基因泰克宣布,美国FDA已发出完整回复函(CRL),拒绝批准 Columvi 联合 吉西他滨 和 奥沙利铂(GemOx) 用于治疗二线弥漫性大B细胞淋巴瘤(DLBCL)患者的补充生物制品许可申请(sBLA)。 CRL 显示,FDA认为STARGLO研究没能提供足够证据来证明这一治疗方案对美国患者群体的益处。据悉,该研究的入组群体中有 59% 来自亚洲或澳大利亚,32% 来自欧洲,仅 9% 来自北美。
8. Replimune——RP1联合PD-1抗体治疗晚期黑色素瘤
7月22日,Replimune宣布溶瘤病毒疗法 RP1 联合PD-1抗体治疗晚期黑色素瘤的上市申请收到FDA的完全回复函,FDA认为IGNYTE临床试验未能提供充分的疗效证据,并指出不能完全归因于受试人群的异质性,同时验证临床的设计也存在问题。此次拒批导致Replimune股价暴跌77%,公司计划与FDA召开会议,寻求解决方案。
9. PTC Therapeutics——vatiquinone
8月19日,PTC Therapeutics宣布美国FDA向其针对FA共济失调的药物 vatiquinone 发出了完整回应函,拒绝批准其新药申请。FDA明确指出vatiquinone未能展现实质性的疗效证据,并要求PTC Therapeutics进行一项新的、设计完善的对照研究,才能支持未来再次提交申请。
10. Outlook Therapeutics——ONS-501
8月28日,FDA再次拒绝了Outlook Therapeutics重新提交的 ONS-501 用于治疗用于治疗湿性年龄相关性黄斑变性(wAMD)的上市申请。在这次发出的完整的回复函中指出,NORSE EIGHT试验未达到主要疗效终点,缺乏足够证据支持ONS-501的有效性。早在2023年,FDA就曾以“生产问题”和“需要额外验证性临床证据”为由拒绝其首次申请。
11. Otsuka&Lundbeck——Rexulti(布瑞哌唑片剂)联合舍曲林
9月20日,Otsuka(大冢制药)和Lundbeck(灵北)共同宣布收到FDA就 Rexulti(布瑞哌唑片剂)联合舍曲林用于治疗创伤后应激障碍(PTSD)成人患者的补充新药申请(sNDA)发出的完整回复函(CRL)。FDA在CRL中表示,已对申请资料进行审查,最终决定拒绝批准该sNDA,并指出申请方没有提供实质性的有效性证据来支持该申请。今年7月,FDA精神药物咨询委员会(PDAC)曾就该sNDA召开会议。讨论结果为,PDAC以10:1的票数反对Rexulti(布瑞哌唑片剂)联合舍曲林用于治疗PTSD的有效性。
被拒原因二:生产问题(5款药物)
1. Atara Biotherapeutics——Ebvallo(Tabelecleucel)
1月16日,Atara Biotherapeutics宣布美国FDA拒绝批准其细胞疗法 Ebvallo(Tabelecleucel)的生物制品许可申请 (BLA)。该申请作为单一疗法治疗2岁及以上患有Epstein-Barr病毒阳性(EBV+)移植后淋巴细胞增殖性疾病(PTLD) 的成人和儿童患者,这些患者之前至少接受过一种疗法,包括含抗CD20的方案。根据新闻稿,本次未获得FDA批准仅与第三方生产商的检查结果有关。CRL中没有提及BLA中的生产工艺、临床疗效或临床安全性数据相关的缺陷,FDA也没有要求进行任何新的临床研究来支持Ebvallo的获批。
2. 恒瑞医药——卡瑞利珠单抗联合甲磺酸阿帕替尼
3月21日,恒瑞医药公告称:收到FDA关于卡瑞利珠单抗联合甲磺酸阿帕替尼用于不可切除或转移性肝细胞癌患者一线治疗的生物制品许可申请的完整回复信。回复信中,FDA表示相关生产场地检查需进一步提交答复,但FDA并未在回复信中说明具体原因。韩国HLB公司方面说法指出,此次FDA拒批的原因仍与卡瑞利珠单抗的生产和质量控制(CMC)问题有关。而“双艾”组合第一次遭拒的原因也涉及CMC问题。
3. Milestone Pharmaceuticals—— Cardamyst (etripamil) 鼻喷雾剂
3月28日,FDA 拒绝批准Milestone Pharmaceuticals的 Cardamyst (etripamil) 鼻喷雾剂 用于治疗阵发性室上性心动过速 (PSVT)。Milestone 指出,CRL主要集中在CMC问题,不涉及临床研究。在CRL中FDA要求:NDA递交后根据新指南递交亚硝胺杂质补充信息;针对NDA审评期间更换的设备开展现场检查以确保其遵循cGMP。
4. Ultragenyx——UX111 (ABO-102)
7月11日,Ultragenyx宣布其AAV基因疗法 UX111 (ABO-102) 用于治疗黏多糖贮积症IIIA型 (MPS IIIA) 的BLA申请收到了美国FDA的完整回复函 (CRL),意味着该疗法的上市申请暂时未获批准。FDA指出的问题集中在两个方面:生产相关信息不充分;生产设施检查中发现的问题需要改进。公司还需针对制造流程补充更多数据,并优化工艺与合规性,才能再次提交申请。此次拒绝并未对临床试验数据或试验中心的检查结果提出异议。不过,FDA要求公司在重新提交申请时,补充现有患者的最新临床数据。
5. 再生元——Odronextamab
8月1日,再生元肿瘤新药 Odronextamab 再次收到完整回应函CRL,遭到FDA的拒绝批准,此次问题出在了第三方生产现场。Odronextamab是一款CD20xCD3双特异性抗体,用于治疗复发或难治性滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)。FDA拒批的理由是其对Catalent Indiana LLC进行了一次非特定于再生元产品的常规现场检查,并发现了阻碍Odronextamab批准的问题。这次检查的观察结果也预计将延迟再生元其他正在审理的FDA申请,包括高剂量EYLEA HD的PDUFA日期。
参考资料:公司公告
想要解锁更多药品信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!














































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论