1.4.1本周全球TOP10创新药研发进展
(1)诺诚健华的奥布替尼在新加坡获批用于治疗边缘区淋巴瘤
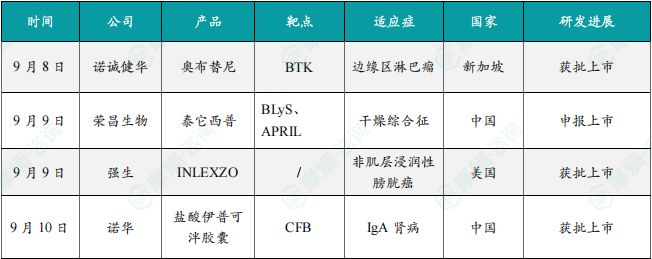
9月8日,诺诚健华宣布,宜诺凯(奥布替尼)已获得新加坡卫生科学局(HSA)的批准,用于治疗复发/难治性边缘区淋巴瘤(R/R MZL)成人患者。这是奥布替尼在新加坡获批的第二项适应症。奥布替尼是诺诚健华自主研发的具有高度靶标选择性的新型BTK抑制剂,可以避免脱靶相关的不良事件,改善安全性和有效性,旨在开发治疗血液肿瘤及自身免疫性疾病。
边缘区淋巴瘤(MZL)是一类惰性B细胞非霍奇金淋巴瘤(NHL),主要影响中老年人群,年发病率在全球范围内呈上升趋势。经过一线治疗后,疾病进展/复发的MZL患者仍缺乏有效的治疗手段。今年4月,奥布替尼在中国获批用于一线治疗慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 (CLL/SLL) 。此前,奥布替尼已在中国获批用于治疗既往至少接受过一次治疗的CLL/SLL、套细胞淋巴瘤(R/R MCL)和边缘区淋巴瘤(R/R MZL),三项适应症均已纳入中国国家医保。
(2)荣昌生物的泰它西普新适应症申报上市,治疗干燥综合征
9月9日,荣昌生物宣布:该公司自主研发的BLyS/APRIL双靶点融合蛋白创新药泰它西普用于治疗干燥综合征(Sjogren's syndrome)的上市申请,已获中国国家药品监督管理局药品审评中心(CDE)正式受理。此次申报基于一项多中心、随机、双盲、安慰剂对照的3期临床研究,旨在评价泰它西普用于治疗干燥综合征患者的有效性和安全性。
8月13日,荣昌生物宣布该研究达到方案设计的临床试验主要研究终点,研究结果显示泰它西普可持续有效改善干燥综合征患者的临床症状,展示出良好的有效性和安全性。详细临床试验数据将在近期举行的国际重大学术会议上公布。研究表明,自身反应性的B细胞过度活化是干燥综合征发病的重要病理基础。泰它西普是由荣昌生物自主研发的双靶点融合蛋白,通过同时抑制B淋巴细胞刺激因子(BLyS)和增殖诱导配体(APRIL)与B细胞表面受体结合,阻止B细胞异常分化和成熟,有效减轻机体的病理性免疫反应。2024年,由多个权威机构联合发布的《B细胞靶向药物治疗风湿免疫病中国专家共识》首次明确推荐泰它西普作为治疗干燥综合征的有效药物。
(3)强生的INLEXZO获FDA批准上市,治疗非肌层浸润性膀胱癌
9月9日,强生宣布INLEXZO(吉西他滨膀胱内释放系统,TAR-200)获得FDA批准上市,用于治疗拒绝或不符合根治性膀胱切除手术、卡介苗(BCG)无反应、伴原位癌(CIS)、伴或不伴乳头状肿瘤的非肌层浸润性膀胱癌(NMIBC)成人患者。
INLEXZO是Taris Biomedical(在2019年12月被强生收购)为希望保留膀胱的患者而设计的一种膀胱内药物释放系统(iDRS),能够将吉西他滨缓释到膀胱中。在门诊环境下,该系统可通过配套的导尿管和管心针在几分钟内植入膀胱,无需全身麻醉或进一步监测。
FDA此次批准主要是基于IIb期SunRISe-1研究队列2的积极结果。该研究是一项单臂、开放标签临床试验,评估了INLEXZO单药治疗BCG无反应、不符合或拒绝接受根治性膀胱切除术的伴CIS、伴或不伴乳头状肿瘤的NMIBC患者的安全性和有效性。队列2的主要终点是任何时间点的完全缓解(CR)率,次要终点包括缓解持续时间(DOR)。结果显示,接受INLEXZO治疗的患者中有82.4%达到CR,这意味着治疗后未发现癌症迹象。这种高缓解率表现出很强的持久性,其中51%的患者保持了至少一年的CR。
(4)诺华新药伊普可泮在中国获批新适应症,治疗IgA肾病
9月10日,诺华宣布全球首创靶向抑制补体旁路途径的口服补体B因子抑制剂盐酸伊普可泮胶囊(商品名:飞赫达)获中国国家药品监督管理局批准,用于降低有疾病快速进展风险的原发性免疫球蛋白A肾病(IgA肾病)成人患者的蛋白尿水平。
伊普可泮是一款靶向补体旁路途径的first-in-class补体因子B(CFB)抑制剂,作用于C5末端通路上游,同时控制血管内溶血和血管外溶血,弥补了抗C5抗体的不足,同时为患者提供了单药口服选择。
此前,该药已在我国获批了3项适应症,分别是:1)用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者;2)适用于已经接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)患者;3)用于治疗成人C3肾小球病(C3G)以降低蛋白尿。
伊普可泮是诺华肾脏疾病治疗领域创新产品组合的重要组成部分,今年诺华已有两款肾脏疾病治疗领域产品的三个适应症相继获批,再次彰显诺华加速创新药物引入,满足中国肾病患者迫切治疗需求的决心和行动力。
(5)恒瑞医药1类新药瑞康曲妥珠单抗拟纳入优先审评
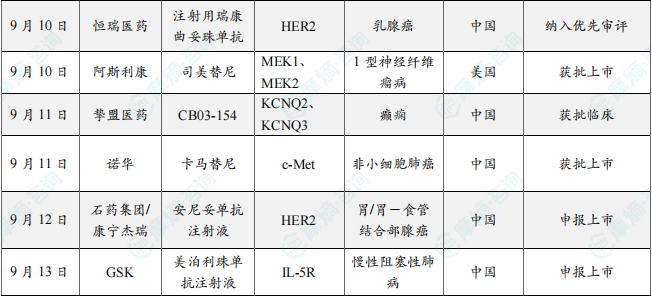
9月10日,中国国家药监局药品审评中心(CDE)官网公示,恒瑞医药的1类新药注射用瑞康曲妥珠单抗拟纳入优先审评,适用于治疗既往接受过一种或一种以上抗HER2药物治疗的局部晚期或转移性HER2阳性成人乳腺癌患者。
公开资料显示,瑞康曲妥珠单抗是一款HER2靶向抗体偶联药物(ADC),已经于今年5月在中国获批上市,用于非小细胞肺癌相关治疗。SHR-A1811(注射用瑞康曲妥珠单抗)是恒瑞医药自主研发的、以HER2为靶点的抗体药物偶联物,拟用于HER2表达或突变的晚期实体瘤的治疗。该产品可特异性结合肿瘤细胞表面上的HER2,随后偶联物被内吞至细胞内并转运至溶酶体中,通过携带的载药在肿瘤细胞内产生药物作用,诱导肿瘤细胞的凋亡。
(6)阿斯利康的司美替尼在美国获批扩人群,覆盖1岁及以上患儿
9月10日,FDA官网显示,阿斯利康的司美替尼(selumetinib)口服颗粒剂获批上市,可用于1岁及以上有症状且无法手术的1型神经纤维瘤病(NF1)相关丛状神经纤维瘤(PN)儿科患者。并且,此前已经获批的口服胶囊剂的适用人群也从2岁及以上儿科患者同步扩大至1岁及以上儿科患者。
此次批准基于口服颗粒剂和已上市口服胶囊剂在健康成人中进行的相对生物利用度(BA)桥接研究(Study 89),以及口服胶囊剂在2岁及以上儿科患者中进行的两项I/II期研究(SPRINT和Stratum)和口服颗粒剂在1岁及以上儿科患者中进行的I/II期SPRINKLE研究。结果显示,两种制剂的暴露量类似,这支持将司美替尼口服颗粒剂的适用人群从2岁及以上儿科患者外推至1岁及以上儿科患者。
(7)挚盟医药在研新药CB03-154获批在中国开展癫痫2期临床试验
9月11日,上海挚盟医药科技有限公司宣布:公司自主研发的新一代KCNQ2/3钾离子通道开放剂CB03-154继今年7月获得中国国家药监局药品审评中心(CDE)针对渐冻症临床2/3期研究的批准后,又于近日获得CDE的临床试验批准,即将在中国开展针对难治性癫痫的2期临床试验。该临床试验是一项随机、双盲、安慰剂对照的多国家、多中心研究,旨在评价CB03-154作为添加治疗在18-70岁局灶性癫痫成人患者中的临床疗效、安全性和耐受性。
CB03-154是挚盟医药研发的新一代KCNQ2/3钾离子通道开放剂,具有良好的化学和代谢稳定性、体外和体内抗癫痫活性和药效、药代性质及安全性,同时也具有更为特异的离子通道选择性,有望克服第一代药物存在的安全性问题。目前,CB03-154 针对癫痫的临床研究也同步在澳大利亚开展。
(8)诺华重磅肺癌药物卡马替尼在中国获批新适应症
9月11日,诺华宣布其重磅抗肿瘤药物卡马替尼在中国成功获批新适应症,用于治疗携带间质上皮转化因子(MET)外显子14跳跃突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
在中国,肺癌的发病率和死亡率均居各类癌症之首,2022年肺癌新发病例 106.06万,占全部恶性肿瘤的22.0%,死亡率占全部恶性肿瘤死亡的28.5%。而在肺癌中,NSCLC患者占比高达80%-85%,且存在多种驱动基因突变。其中,METex14跳跃突变是关键驱动基因之一。METex14跳跃突变会导致c-Cbl酪氨酸结合位点丢失,从而引起蛋白酶体介导的MET蛋白降解率降低,使下游信号通路持续激活,进而促进肿瘤细胞的迁移、增殖和侵袭。
卡马替尼是一种口服生物利用度高、高选择性的特异性MET受体酪氨酸激酶抑制剂,可有效抑制MET及MET介导的下游信号蛋白的磷酸化,从而抑制肿瘤细胞的增殖和迁移,并有效诱导细胞凋亡,展现出抗肿瘤活性。作为诺华在肺癌领域的核心产品之一,卡马替尼已于2024年在中国获批用于未经系统治疗的携带METex14跳跃突变的局部晚期或转移性NSCLC成人患者。此次新适应症的获批,进一步扩大了卡马替尼的适用人群。
(9)石药集团/康宁杰瑞HER2双抗安尼妥单抗注射液申报上市
9月12日,国家药品监督管理局(NMPA)药品审评中心(CDE)官网显示,石药集团和康宁杰瑞开发的安尼妥单抗注射液的上市申请已获受理,适应症为:联合化疗用于治疗至少接受过一种系统性治疗(必须包含曲妥珠单抗联合化疗)失败的人表皮生长因子受体2阳性(HER2+)局部晚期、复发或转移性胃/胃-食管结合部腺癌(GC/GEJ)。
安尼妥单抗最初由康宁杰瑞开发,它可以同时结合至两种不同的经临床验证的HER2表位(表位II及IV),并保留野生型Fc区。这使得该药能够双重阻断HER2相关信号通路、增强与HER2受体的结合、减少细胞表面的HER2蛋白,及通过完整的抗体依赖性细胞介导的细胞毒性增强对肿瘤的杀伤效果。
2021年8月,石药集团获得了安尼妥单抗在中国的独家开发和商业化权益。
本次新药上市申请主要是基于一项关键II/III期临床试验,其期中分析结果显示,与现有标准治疗相比,安尼妥单抗联合化疗显著提高临床疗效,延长患者的无进展生存期(PFS)和总生存期(OS),且在安全性方面无新发安全性风险,心脏毒性发生率低,免疫原性低。
此外,安尼妥单抗已于2023年11月4日获国家药监局药品审评中心授予突破性治疗药物认定,并已于2025年8月28日获优先审评审批资格。
(10)GSK首创IL-5单抗美泊利珠单抗注射液在华申报新适应症
9月13日,CDE网站显示,GSK的美泊利珠单抗注射液申报新适应症。根据临床开发进度,推测此次申报的新适应症为慢性阻塞性肺病(COPD)。美泊利珠单抗是GSK开发的一款全球首创IL-5单抗,给药频率为每月一次。
2021年11月,美泊利珠单抗首次在华获批上市,用于成人治疗嗜酸性肉芽肿性多血管炎。此后,美泊利珠单抗又陆续获NMPA批准扩展两项新适应症,分别是嗜酸性粒细胞性重度哮喘和慢性鼻窦炎伴鼻息肉。
COPD是全球第三大死亡原因,全球约有3.9亿例COPD患者。大约40%的COPD患者的疾病诱因和疾病恶化因素为2型炎症反应,其特征是血嗜酸性粒细胞水平升高。
今年5月,美泊利珠单抗已获FDA批准用于附加维持治疗嗜酸性粒细胞表型COPD,成为第一个获批COPD适应症的IL-5药物,也是COPD领域首个可每月给药的生物制剂。
1.4.2本周全球TOP10积极/失败临床结果
(1)Stoke Therapeutics与渤健公布zorevunersen 1/2a期临床试验数据
9月8日,Stoke Therapeutics公司与渤健(Biogen)共同宣布了针对Dravet综合征的在研ASO药物zorevunersen的最新研究进展。该药物旨在通过增强SCN1A基因非突变(野生型)拷贝的功能,提升脑细胞中NaV1.1蛋白的表达,从而治疗Dravet综合征的根本病因。目前,zorevunersen正处于3期EMPEROR关键性临床试验阶段。此前,该药物已证明其对Dravet综合征的缓解潜力,获得了美国FDA授予的突破性疗法认定、罕见儿科疾病认定,以及FDA和EMA授予的孤儿药资格。Stoke公司拥有该药在美国、加拿大和墨西哥的独家权益,渤健则拥有其余地区的商业化权利。
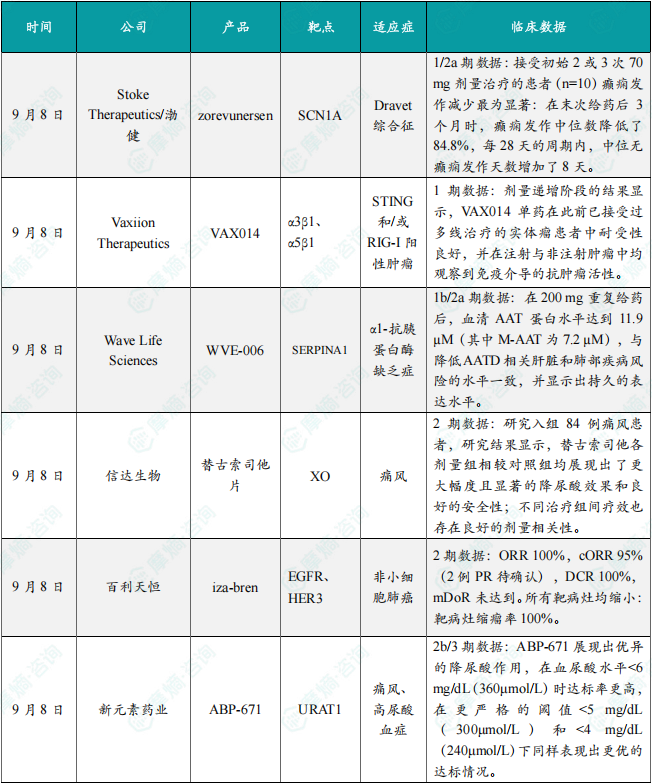
此次公布的数据表明,zorevunersen在长达四年多的临床研究中展现出持久的疗效和良好的安全性。在1/2a期研究中,接受初始2或3次70 mg剂量治疗的患者(n=10)癫痫发作减少最为显著:在末次给药后3个月时,癫痫发作中位数降低了84.8%,每28天的周期内,中位无癫痫发作天数增加了8天。在1/2a期研究中接受治疗后,94%的患者进入后续的开放标签扩展研究,继续接受每四个月一次zorevunersen治疗的患者在3年内不仅实现了癫痫发作频率显著且持久的降低,还表现出认知功能和行为的持续改善。在已经使用标准抗癫痫药物的患者中,联用zorevunersen使患者的无癫痫发作天数大幅增加,生活质量获得了持续改善。安全性方面,zorevunersen在所有研究中整体耐受性良好。新闻稿指出,zorevunersen有望成为首个具有改变Dravet综合征疾病进程潜力的疗法。
(2)Vaxiion Therapeutics公司公布在研疗法VAX014 1期临床试验初步数据
9月8日,Vaxiion Therapeutics公司宣布,其在研溶瘤免疫疗法VAX014的1期临床试验取得重要进展,剂量递增阶段已完成,将启动1b期剂量扩展阶段。
VAX014是一种潜在“first-in-class”、基于细菌微细胞的泛肿瘤靶向疗法,通过原位免疫促进抗肿瘤免疫反应,靶向STING和/或RIG-I阳性肿瘤。VAX014无需生物安全二级(BSL-2)防护,与溶瘤病毒疗法相比显著增加了患者的可及性。Vaxiion公司的重组细菌微细胞(rBMCs)是一种微小的球形纳米级细菌颗粒,含有亲本细菌除细菌染色体外的所有分子成分。由于缺乏染色体,rBMCs无法进行复制,因此非常适合作为体内靶向递送药物的开发平台。剂量递增阶段的结果显示,VAX014单药在此前已接受过多线治疗的实体瘤患者中耐受性良好,并在注射与非注射肿瘤中均观察到免疫介导的抗肿瘤活性。目前,1b期研究正在进行患者招募,该研究采用适应性设计,旨在评估VAX014联合PD-1抑制剂在PD-1治疗失败患者中的疗效。
(3)Wave Life Sciences公司在研药物WVE-006 1b/2a期临床试验取得积极结果
9月8日,Wave Life Sciences公司宣布,其用于治疗α1-抗胰蛋白酶缺乏症(AATD)的在研药物WVE-006在1b/2a期RestorAATion-2研究中取得积极数据。
WVE-006是一款潜在“first-in-class”的RNA编辑寡核苷酸疗法,基于Wave Life Sciences独有的AIMer平台,能够将腺嘌呤编辑为肌苷(A-to-I),并通过PN化学修饰与GalNAc偶联实现靶向肝脏的皮下注射给药。WVE-006旨在修复AATD患者SERPINA1基因中导致Z突变的单碱基错误,从而恢复功能性野生型AAT蛋白(M-AAT)的表达,并减少有害的Z-AAT蛋白聚集,有望用于治疗与AATD相关的肺病和/或肝病。
此次公布的结果显示,在200 mg重复给药后,血清AAT蛋白水平达到11.9 µM(其中M-AAT为7.2 µM),与降低AATD相关肝脏和肺部疾病风险的水平一致,并显示出持久的表达水平。值得一提的是,研究首次在一名Pi*ZZ个体中观察到血清AAT水平的生理性恢复,总AAT水平达20.6 µM,其中M-AAT为10.3 µM。此外,单次400 mg给药实现了12.8 µM的总AAT和5.3 µM的M-AAT,正在进行的400 mg多次给药队列有望进一步提高血清AAT水平。来自200 mg和400 mg队列的数据均支持每月或更低频次的皮下注射方案,每月一次400 mg多次给药队列的最新数据预计将在2026年第一季度公布。至今,WVE-006表现出良好的耐受性和安全性。
(4)信达生物痛风新药替古索司他片2期临床研究结果积极
9月8日,信达生物宣布:黄嘌呤氧化酶抑制剂(XOI)替古索司他片(研发代号:IBI128)在中国痛风患者中的2期临床研究的主要结果在2025年亚太风湿病协会联盟大会(APLAR)发表。研究结果显示,替古索司他各剂量组相较对照组均展现出了更显著的降尿酸效果以及良好的安全性。基于该积极结果,信达生物计划于2025年下半年启动替古索司他片(IBI128)中国注册临床3期研究。
此次发表的结果是基于一项探索不同剂量替古索司他片(IBI128)在中国痛风患者中有效性和安全性的随机、开放、多中心、平行、活性对照的2期临床研究(NCT06501534)。研究入组84例痛风患者,研究结果显示,替古索司他各剂量组相较对照组均展现出了更大幅度且显著的降尿酸效果和良好的安全性;不同治疗组间疗效也存在良好的剂量相关性。
(5)百利天恒公布EGFR/HER3双抗ADC伦康依隆妥单抗联合疗法2期积极数据
9月8日,百利天恒公布了奥希替尼联合其EGFR/HER3双抗ADC伦康依隆妥单抗(iza-bren)治疗局晚期或转移性EGFR突变非小细胞肺癌患者的II期临床研究数据:截至2025年3月10日,该研究共纳入154例患者接受不同剂量iza-bren (EGFR×HER3双抗ADC) 联合奥希替尼治疗,其中40例患者接受iza-bren 2.5mg/kg D1D8 Q3W联合奥希替尼一线治疗,研究结果如下:所有患者均为最佳应答:ORR 100%,cORR 95%(2例PR待确认),DCR 100%,mDoR未达到。所有靶病灶均缩小:靶病灶缩瘤率100%。PFS率和OS率双双突破:mPFS未达到,12个月PFS率92.1%;mOS未达到,12个月OS率94.8%。安全性可耐受:本研究中仅2.4%患者接受过粒细胞集落刺激因子(G-CSF)一级预防治疗,iza-bren联合奥希替尼安全可耐受,血液学毒性为主,≥G3级中性粒细胞减少消退快(中位6-7天)且导致停药率低(0.8%)。未报告发热性中性粒细胞减少症。
(6)新元素药业痛风新药ABP-671全球2b/3期临床取得积极结果
9月8日,新元素药业公布了ABP-671的全球IIb/III期临床试验数据。该研究在美国、欧洲、澳洲、拉丁美洲和中国台湾等多地开展,采用“Treat-to-Target”策略,别嘌醇剂量最高可达800mg。核心数据表现如下:
降尿酸水平(SUA):ABP-671展现出优异的降尿酸作用,在血尿酸水平<6 mg/dL(360μmol/L)时达标率更高,在更严格的阈值<5 mg/dL(300μmol/L)和<4 mg/dL(240μmol/L)下同样表现出更优的达标情况。痛风石与急性发作:在15–28周观察期内,ABP-671显著降低急性痛风发作频率,风险下降率达42%。至第28周时,受试者痛风石直径较基线出现显著减小,反应率达到91%。安全性:推荐的III期临床剂量组总体不良事件发生率与安慰剂组相当。相较于其他降尿酸药物(如非布司他、苯溴马隆),ABP-671迄今未见心血管或肝毒性风险信号。
(7)BioNTech与BMS联合开发的pumitamig 2期临床试验中期数据公布
9月9日,BioNTech与百时美施贵宝(Bristol Myers Squibb)公布其所联合开发的在研双特异性抗体pumitamig联合化疗,在全球随机2期临床试验中,用以治疗广泛期小细胞肺癌(ES-SCLC)患者的中期数据。结果显示,该疗法具有令人鼓舞的抗肿瘤活性,确认客观缓解率(cORR)达76.3%,疾病控制率(DCR)达100%。
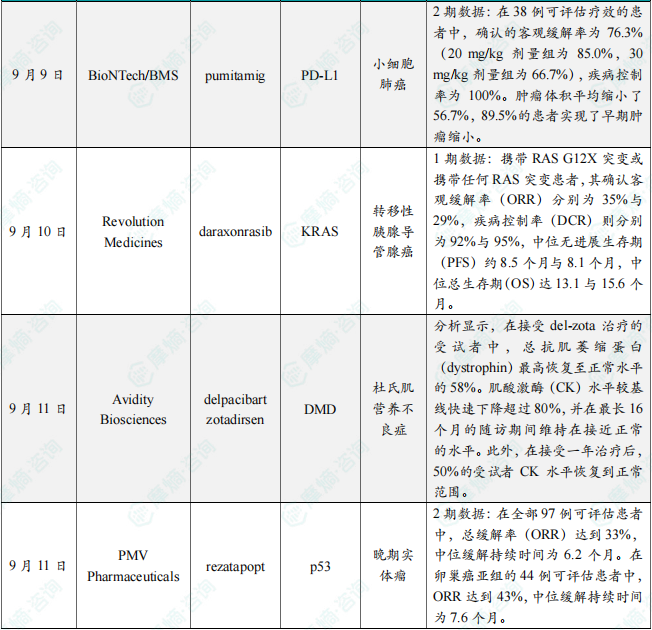
目前一项名为ROSETTA-LUNG-01的全球随机3期临床试验正在进行中,该研究评估pumitamig联合化疗与PD-L1抑制剂atezolizumab联合化疗相较,作为未经治疗ES-SCLC患者一线疗法的疗效与安全性。此次中期分析纳入了43例未经治疗的广泛期小细胞肺癌患者(队列1),这些患者在两个剂量水平下接受了pumitamig联合标准化疗。截止至2025年8月7日,在38例可评估疗效的患者中,确认的客观缓解率为76.3%(20 mg/kg剂量组为85.0%,30 mg/kg剂量组为66.7%),疾病控制率为100%。肿瘤体积平均缩小了56.7%,89.5%的患者实现了早期肿瘤缩小。中位无进展生存期(mPFS)为6.8个月(20 mg/kg剂量组为6.3个月,30 mg/kg剂量组为7.0个月),而中位总生存期(mOS)在分析时尚未成熟。
(8)Revolution Medicines公布daraxonrasib临床1期试验最新进展
9月10日,Revolution Medicines宣布了其RAS(ON)多重选择性抑制剂daraxonrasib(RMC-6236)临床1期试验的最新进展。初步结果显示,无论是daraxonrasib单药治疗,还是联合化疗方案,在一线转移性胰腺导管腺癌(PDAC)患者中均展现出积极疗效。这些数据为公司计划于2025年第四季度启动的3期临床试验提供了有力支持。分析显示,在二线及以上(2L+)转移性PDAC患者中,接受每日一次(QD)300 mg daraxonrasib治疗的患者表现出良好的耐受性,安全性与既往数据一致。疗效方面,携带RAS G12X突变或携带任何RAS突变患者,其确认客观缓解率(ORR)分别为35%与29%,疾病控制率(DCR)则分别为92%与95%,中位无进展生存期(PFS)约8.5个月与8.1个月,中位总生存期(OS)达13.1与15.6个月。
目前,daraxonrasib单药在二线转移性PDAC中的注册性3期临床试验RASolute 302正在进行中,预计今年完成全球患者入组,并于2026年公布数据。在一线转移性PDAC患者中,daraxonrasib 300 mg QD单药治疗同样取得了积极结果。截至2025年7月28日,该队列40例患者总体耐受性良好。在具足够随访时长的38例患者中,ORR达47%,DCR达89%,中位随访时间为9.3个月。多数患者在数据截止时仍在接受治疗,需进一步随访以确认获益的持久性。
(9)Avidity Biosciences治疗DMD突破性疗法亮眼数据公布
9月11日,Avidity Biosciences宣布,其在研疗法delpacibart zotadirsen(del-zota)在EXPLORE44和EXPLORE44-OLE试验中取得了积极的新数据。分析显示,持续接受del-zota治疗一年的杜氏肌营养不良症(DMD)患者在多项功能性指标上,显示疾病进展得到逆转,并且相比基线和自然病程呈现出“史无前例”的改善。Avidity计划于2025年底向美国FDA提交del-zota的生物制品许可申请(BLA)。
EXPLORE44试验是一项随机、安慰剂对照、双盲的1/2期临床试验,入组患者为适用于外显子44跳跃治疗的杜氏肌营养不良症(DMD44)患者。EXPLORE44-OLE则是一项开放标签、多中心试验,旨在评估del-zota在DMD44患者中的长期安全性、耐受性、药代动力学、药效学作用及疗效。分析显示,在接受del-zota治疗的受试者中,总抗肌萎缩蛋白(dystrophin)最高恢复至正常水平的58%。肌酸激酶(CK)水平较基线快速下降超过80%,并在最长16个月的随访期间维持在接近正常的水平。此外,在接受一年治疗后,50%的受试者CK水平恢复到正常范围。该疗法曾在2025年7月获美国FDA授予突破性疗法认定,用于治疗适用于外显子44跳跃治疗的杜氏肌营养不良症患者。
(10)PMV Pharmaceuticals公布rezatapop 2期临床试验中期数据
9月11日,PMV Pharmaceuticals公布了其PYNNACLE关键性临床1/2期试验中,2期部分的中期数据。该试验旨在评估rezatapopt(PC14586)在携带TP53 Y220C突变的晚期实体瘤患者中的疗效。Rezatapopt是一款潜在“first-in-class”的小分子p53再激活剂,能够选择性结合p53 Y220C突变蛋白的特定口袋,从而恢复其野生型抑癌功能。中期结果显示,该药物在卵巢癌、肺癌、乳腺癌、子宫内膜癌、头颈癌、结直肠癌、胆囊癌及壶腹癌等八种肿瘤类型中均观察到确认的治疗应答。在全部97例可评估患者中,总缓解率(ORR)达到33%,中位缓解持续时间为6.2个月。在卵巢癌亚组的44例可评估患者中,ORR达到43%,中位缓解持续时间为7.6个月。基于这些积极结果,公司计划于2027年第一季度提交rezatapopt用于治疗铂类耐药或复发性卵巢癌的新药申请(NDA)。
同期事件:
1. 2025年第37周09.08-09.14国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第37周09.08-09.14国内仿制药/生物类似物申报/审批数据分析
3. 2025年第37周09.08-09.14国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.09.08-2025.09.14) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论