1.4.1 本周全球TOP10创新药研发进展
(1)乐普生物子公司美雅珂的MRG004A拟纳入突破性治疗品种
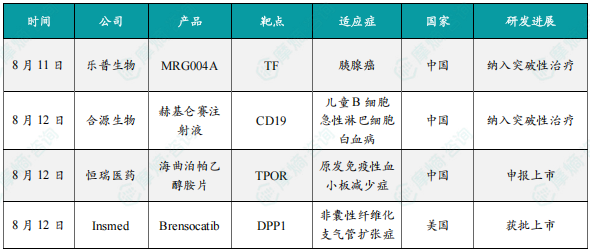
8月11日,乐普生物MRG004A被NMPA拟纳入突破性治疗品种,用于既往经至少二线系统性治疗失败的晚期胰腺癌患者。MRG004A是乐普生物子公司美雅珂基于Synaffix的专有技术平台开发的一款靶向组织因子(TF)的ADC药物,其有效载荷为MMAE。在2024年ASCO大会上,乐普生物首次披露了MRG004A的实体瘤I/II期MRG004A-001研究的初步疗效和安全性数据,该研究共纳入了19例胰腺癌患者。结果显示,在接受MRG004A(2.0mg/kg)治疗的12例可评估疗效的胰腺癌患者中,4例达到部分缓解(PR),6例达到疾病稳定(SD),ORR为33.3%(4/12),DCR高达83.3%(10/12)。
(2)合源生物的赫基仑赛注射液拟纳入突破性治疗品种,用于治疗儿童白血病
8月12日,国家药品监督管理局官网显示,合源生物科技(天津)有限公司开发的赫基仑赛注射液(即纳基奥仑赛注射液)拟纳入突破性治疗品种,拟定适应症为儿童复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。赫基仑赛注射液(曾用名:CNCT19细胞注射液,Inaticabtagene Autoleucel)是一款靶向CD19 的CAR-T细胞治疗产品,具有全球独特的CD19 scFv(HI19a)结构。其作用机制是通过基因工程技术,对患者自身的T细胞进行改造。改造后的T细胞表面表达能特异性识别CD19抗原的受体,当这些CAR-T细胞回输到患者体内后,能够精准识别并结合表达CD19的肿瘤细胞和正常B细胞。一旦结合,CD28和CD3-zeta共刺激结构域会激活下游级联信号,促使T细胞活化、增殖,获得强大的效应功能,并分泌炎症细胞因子和趋化因子,最终实现对表达CD19细胞的杀伤,达到治疗肿瘤的目的。
(3)恒瑞医药1类新药海曲泊帕新适应症申报上市
8月12日,恒瑞医药宣布其自主研发的1类新药海曲泊帕乙醇胺片的药品上市许可申请获中国国家药监局(NMPA)受理,适应症为:适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的原发免疫性血小板减少症(ITP)成人及≥6岁的儿童患者。海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体激动剂,通过激活血小板生成素受体介导的STAT和MAPK信号转导通路,促进血小板生成。该产品已在原发免疫性血小板减少症、再生障碍性贫血、化疗所致血小板减少症、有创性操作或手术的慢性肝病伴血小板减少症患者中开展临床研究,以评估在不同血液系统疾病中的作用。海曲泊帕乙醇胺片已获批上市两个适应症,分别为:2021年6月获得NMPA批准用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症成人患者的治疗,以及用于对免疫抑制治疗疗效不佳的重型再生障碍性贫血成人患者的治疗。此外,该产品用于恶性肿瘤化疗所致血小板减少症适应症(CIT)已获美国FDA授予孤儿药资格。
(4)Insmed的Brensocatib获FDA批准上市
8月12日,Insmed宣布Brensocatib(商品名:Brinsupri)获FDA批准上市,用于治疗12岁及以上儿童和成人非囊性纤维化支气管扩张症患者,这标志着该疾病领域迎来首款靶向治疗药物。Brensocatib是阿斯利康开发的一款口服、可逆、小分子二肽基肽酶1(DPP-1)抑制剂,通过抑制DPP-1阻止嗜中性粒细胞丝氨酸蛋白酶(NSP)活化,进而抑制中性粒细胞介导的炎症反应。2016年10月,Insmed与阿斯利康达成协议,获得Brensocatib的全球独家开发和商业化权益。此次批准主要基于3期ASPEN研究及2期WILLOW研究的积极数据,这两项研究均已发表于《新英格兰医学杂志》。在ASPEN研究中,接受10 mg或25 mg Brinsupri治疗的患者,其年度病情加重发生率较安慰剂组分别降低了21.1%和19.4%。两种剂量均达到多项与病情加重相关的次要终点,包括显著延长出现首次病情加重所需时间,以及显著提高整个治疗期间保持无病情加重状态患者的比例。根据第52周时,在吸入支气管扩张剂后进行的第一秒用力呼气量(FEV₁)评估,接受25 mg剂量治疗患者的肺功能下降显著减缓。
(5)复宏汉霖/亿胜生物的贝伐珠单抗眼内注射液申报上市
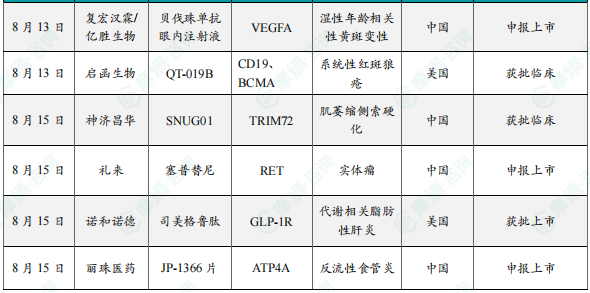
8月13日,CDE官网显示,复宏汉霖和亿胜生物共同开发的贝伐珠单抗眼内注射液(HLX04-O)申报上市。HLX04-O是复宏汉霖利用基因工程技术构建的一款重组抗血管内皮生长因子(VEGF)人源化单抗,能够特异性结合VEGF,阻断VEGF与内皮细胞上的受体Flt1(VEGFR-1)和KDR(VEGFR-2)结合,抑制其酪氨酸激酶信号通路的激活,进而抑制内皮细胞增生,减少新生血管生成,从而实现对湿性年龄相关性黄斑变性(wAMD)等血管增生眼部疾病的治疗。根据眼科用药需求,复宏汉霖在汉贝泰(HLX04,贝伐珠单抗生物类似药)的基础上保持活性成分不变,对处方、包装材料、规格和生产工艺等进行优化,开发了新的眼科制剂产品HLX04-O。2020年10月,亿胜生物与复宏汉霖达成全球许可协议,获得HLX04-O就眼科适应症的共同开发权益。
(6)启函生物通用型双靶点CAR-T细胞产品QT-019B在美国获批临床
8月13日,启函生物宣布,其自主研发的首款通用型双靶点CAR-T细胞产品QT-019B的新药临床试验申请已获得美国FDA的正式批准。QT-019B是第1个由中国企业自主研发并获得美国FDA临床试验批准的治疗自身免疫性疾病的通用型CAR-T细胞产品。公司计划在美国开展QT-019B治疗难治性系统性红斑狼疮(rSLE)的临床1/2期试验,主要临床研究单位为美国宾夕法尼亚大学医院(Hospital of the University of Pennsylvania)。QT-019B细胞注射液是由启函生物开发的一种“现货型”同种异体CAR-T细胞产品。QT-019B细胞是以健康供者外周血的白细胞单采产物为起始原材料,经基因编辑,稳定表达两种不同的嵌合抗原受体(CAR),分别靶向CD19和BCMA,从而使QT-019B具备同时识别并清除表达CD19和BCMA细胞的能力。为降低移植物抗宿主病(GvHD)风险,产品通过基因敲除方式消除了T细胞受体(TCR)的表达;同时,为减少同种异体免疫排斥,启函生物通过多基因的编辑来实现低免疫原性,从而降低患者自身的NK细胞与T细胞介导的识别与细胞毒性作用。
(7)神济昌华渐冻症1类新药SNUG01获批临床
8月15日,中国国家药监局药品审评中心(CDE)官网公示,神济昌华申报的1类新药SNUG01获批临床,拟开发治疗肌萎缩侧索硬化(ALS,俗称“渐冻症”)。公开资料显示,这是神济昌华自主研发的以TRIM72为靶点的基因治疗药物。根据神济昌华新闻稿介绍,此次IND获批是SNUG01继2025年3月获美国FDA临床试验许可,6月获FDA授予孤儿药资格后,取得的又一重要里程碑,标志着SNUG01进入中美国际多中心临床试验(MRCT)开发阶段。根据神济昌华新闻稿介绍,该公司基于清华大学贾怡昌教授实验室在靶点方向的原创性发现,聚焦ALS致病机制研究,成功开发出这款基因治疗药物SNUG01。该产品以重组腺相关病毒9型(rAAV9)为载体,通过鞘内注射(IT)的方式,将人源TRIM72基因靶向递送至神经元。临床前研究表明,TRIM72可能通过膜修复功能、抗氧化/线粒体功能修复、减少应激颗粒产生等多重机制保护神经元,延缓ALS患者的运动神经元退行性病变。
(8)礼来RET抑制剂塞普替尼新适应症申报上市
8月15日,国家药品监督管理局(NMPA)药品审评中心(CDE)官网显示,礼来的塞普替尼新适应症上市申请已获受理。根据其注册性临床研究进展,推测此次申报的适应症为治疗RET基因融合的局部晚期或转移性实体瘤儿童患者。塞普替尼是一种强效、高选择性、口服RET酪氨酸激酶抑制剂,该药于2020年5月首次获FDA批准上市,成为全球首个获批的高选择性RET抑制剂。一项评估塞普替尼治疗携带RET基因改变的晚期实体瘤或神经系统原发性肿瘤儿科患者的疗效和安全性的I/II期研究(LIBRETTO-121研究)最新结果显示,中位随访30个月,在可评估患者(n=36)中,ORR为36%,24个月的DOR率为100%,24个月的PFS率为86%。其中,在15例RET突变型甲状腺髓样癌患者中,ORR为40%;在15例RET融合阳性甲状腺状癌患者中,ORR为33.3%。
(9)司美格鲁肽获FDA批准治疗MASH
8月15日,诺和诺德宣布司美格鲁肽(Wegovy)的补充新药申请(sNDA)获FDA批准,用于结合减少卡路里饮食和增加体力活动治疗伴有中晚期肝纤维化(F2期或F3期)的代谢功能障碍相关性脂肪性肝炎(MASH)患者。FDA此次批准是基于III期ESSENCE研究Part 1的积极结果。该研究是一项为期240周的随机、双盲、安慰剂对照临床试验(n=1200),评估了司美格鲁肽(2.4mg,每周1次,皮下注射)治疗伴有中晚期肝纤维化(F2期或F3期)的MASH成人患者的疗效和安全性。ESSENCE试验由两部分组成,Part 1的目标是根据前800例随机患者的活检取样,证明2.4mg司美格鲁肽治疗72周后可改善肝脏组织学。在Part 2中,目标是证明与安慰剂相比,使用司美格鲁肽2.4 mg治疗可在240周时降低MASH和中晚期肝纤维化成人患者发生肝脏相关临床事件的风险。Part 1的结果显示,在第72周时,2.4mg司美格鲁肽组患者的肝纤维化较安慰剂组显著改善且没有出现脂肪性肝炎恶化,脂肪性肝炎得到了缓解且没有出现肝纤维化恶化。此外,2.4mg司美格鲁肽组和安慰剂组实现肝纤维化改善且脂肪性肝炎没有恶化的患者比例分别为36.8%和22.4%,实现脂肪性肝炎得到缓解且肝纤维化没有恶化的患者比例分别为62.9%和34.3%。在该试验中,2.4mg司美格鲁肽的安全性和耐受性与既往研究一致。ESSENCE研究的Part 2将继续进行,预计在2029年得出结果。
(10)丽珠医药引进的JP-1366片国内申报上市
8月15日,丽珠医药发布公告,其申请的JP-1366片的注册上市许可申请获国家药品监督管理局受理,适应症为反流性食管炎。JP-1366片是一款创新钾离子竞争性酸阻滞剂(P-CAB),可以通过竞争性阻断H(+)、K(+)-ATP酶(质子泵)的K(+)通道,阻滞K(+)与质子泵的结合,抑制胃酸的分泌,从而达到促进食管黏膜愈合和改善反流症状的效果。JP-1366片提升胃内pH值的速率较快,且可长时间维持胃内pH值>4,能有效地解决夜间酸突破。2023年3月,丽珠医药与Onconic Therapeutics就该药签署了许可协议,丽珠医药获得在中国大陆、香港特别行政区、澳门特别行政区及台湾地区内开发、制造和商业化该药的授权,支付1500万美元的首付款,以及不超过1.125亿美元的技术转移费用、相应的开发里程碑金及销售里程碑金。
1.4.2 本周全球TOP10积极/失败临床结果

(1)Assembly Biosciences公布ABI-5366 1b期临床试验数据
8月11日,Assembly Biosciences公司公布了一种用于治疗复发性生殖器疱疹的长效解旋酶-引物酶抑制剂ABI-5366的1b期临床试验数据。该候选疗法通过靶向病毒解旋酶-引物酶复合体发挥作用。这是一种在HSV-1和HSV-2中都保守的重要病毒酶复合体,并且宿主细胞中没有类似的酶复合体。在短期临床研究中,HSV解旋酶-引物酶抑制剂显示出比核苷类似物更佳的疗效潜力。在具有统计效力的主要抗病毒终点——HSV-2病毒脱落率方面,接受每周350 mg剂量的队列在29天的评估期内,病毒脱落率较安慰剂组显著降低了94%(p<0.01),显示出强效的抗病毒活性。这一降幅超过了Assembly Biosciences公司为本研究设定的80%-85%的降低目标。在一项次要临床终点——生殖器病变发生率方面,相比于安慰剂组,每周350 mg剂量组的发生率降低94%(p<0.01)。此外,在评估ABI-5366每周口服剂量的前两个队列中,观察到了良好的安全性和耐受性特征。
(2)诺华单抗ianalumab两项3期临床试验成功,用于治疗干燥综合征
8月11日,诺华宣布了一项里程碑式的进展,其ianalumab (VAY736) 在两项全球三期临床试验(NEPTUNUS-1和NEPTUNUS-2)中均达到了主要终点,这标志着在治疗干燥综合征方面取得了积极的顶线结果。这些试验是首次在全球范围内证明能显著降低干燥综合征患者疾病活动度的三期临床试验,并且ianalumab有望成为首个也是唯一一个获得批准的干燥综合征靶向治疗药物。NEPTUNUS-1和 NEPTUNUS-2是全球多中心的关键性三期临床研究,旨在全面评估ianalumab在活动性腺体外病变的干燥综合征患者中的疗效和安全性。这些试验的主要终点是根据EULAR干燥综合征疾病活动指数 (ESSDAI) 衡量的全身疾病活动度的改善。NEPTUNUS-1是一项随机、双盲、两组多中心三期试验 (N=275),旨在评估每月皮下注射300毫克ianalumab相较于安慰剂在52周内的临床疗效、安全性和耐受性。NEPTUNUS-2则是一项随机、双盲、三组多中心三期试验 (N=504),评估每月或每三个月皮下注射300毫克ianalumab相较于安慰剂在52周内的临床疗效、安全性和耐受性。两项试验均成功达到主要终点,表明ianalumab能够有效改善患者的疾病活动度。
(3)默沙东公布帕博利珠单抗联合疗法3期积极结果,针对膀胱癌
8月12日,默沙东宣布帕博利珠单抗(Keytruda)联合维恩妥尤单抗(Padcev)围手术期治疗肌层浸润性膀胱癌(MIBC)的III期KEYNOTE-905(EV-303)研究取得了积极结果。KEYNOTE-905(EV-303)研究是一项开放标签、随机、多臂、对照临床试验(n=595),评估了帕博利珠单抗联合或不联合维恩妥尤单抗对比与仅手术治疗在不适合或拒绝基于顺铂的化疗方案的MIBC患者中的有效性和安全性。结果显示,与仅手术治疗组相比,帕博利珠单抗联合维恩妥尤单抗组患者的无事件生存期(EFS)显著延长,数据具有统计学意义和临床意义。此外,帕博利珠单抗联合维恩妥尤单抗组在关键次要终点总生存期(OS)和病理完全缓解(pCR)率方面也表现出具有统计学意义和临床意义的改善。在该研究中,帕博利珠单抗联合维恩妥尤单抗的安全性与每种药物的已知安全性一致。该联用方案未发现新的安全性信号。
(4)IO Biotech癌症疫苗联合疗法关键临床3期结果公布
8月12日,IO Biotech公布其在研癌症疫苗Cylembio(imsapepimut与etimupepimut,配合佐剂)关键临床3期试验的主要结果。该试验在407例不可切除或转移性黑色素瘤患者中,评估Cylembio联合默沙东(MSD)的PD-1抑制剂Keytruda(pembrolizumab)与pembrolizumab单药作为一线治疗的疗效。分析显示,联合治疗组在无进展生存期(PFS)方面较单药组有所改善,风险比为0.77(95% CI:0.58-1.00),中位PFS分别为19.4个月与11.0个月,但主要终点的统计学显著性(p=0.056)略低于预设阈值(p≤0.045)。在未接受过新辅助/辅助PD-1抑制剂治疗的患者亚组(n=371)中,联合治疗的风险比为0.74(95% CI:0.56-0.98,p=0.037),中位PFS延长至24.8个月,相较对照组的11.0个月有所提升。几乎所有亚组均观察到PFS改善,其中PD-L1阴性肿瘤患者的受益尤为显著(HR=0.54,95% CI:0.35-0.85,p=0.006),中位PFS为16.6个月,对照组为3.0个月。研究还观察到联合治疗组在总生存期(OS)方面呈改善趋势(HR=0.79,95% CI:0.57-1.10),但数据尚未成熟。Cylembio联合pembrolizumab耐受性良好,未发现新的安全性信号。
(5)诺华单抗ianalumab联合疗法3期研究成功,用于治疗免疫性血小板减少症
8月12日,诺华抗BAFF-R单抗ianalumab再次传来积极消息,该药物联合艾曲泊帕治疗原发性免疫性血小板减少症(ITP)的III期VAYHIT2研究也达到了主要终点。VAYHIT2研究是是一项随机、双盲、多中心III期临床试验,评估了ianalumab(3mg/kg或9mg/kg,皮下注射,每月1次)联合艾曲泊帕对比安慰剂联合艾曲泊帕治疗既往经皮质类固醇一线治疗后失败的原发性ITP患者的有效性和安全性。主要终点是治疗失败的时间(定义为从随机分组到以下任一时间:随机分组后8周内血小板计数低于30G/L;随机分组后8周内需要抢救治疗;随时开始新的ITP治疗;不符合或无法逐渐减量/停用艾曲波帕;或死亡)。结果显示,ianalumab组患者的治疗失败时间较安慰剂组显著延长。此外,在治疗6个月时,ianalumab组实现血小板计数持续改善的患者比例显著提高。安全性方面,ianalumab在该研究中的表现与既往研究一致,没有发现新的安全性信号。
(6)荣昌生物泰它西普治疗原发性干燥综合征3期临床达到主要终点
8月13日,荣昌生物宣布:公司自主研发的全球首创BLyS/APRIL双靶点融合蛋白创新药泰它西普用于治疗原发性干燥综合征(pSS)的Ⅲ期临床研究,达到方案设计的临床试验主要研究终点,将尽快向国家药品监督管理局药品审评中心(CDE)递交上市申请,详细数据将在国际重大学术会议上公布。这是一项多中心、随机、双盲、安慰剂对照的Ⅲ期临床研究,旨在评价泰它西普用于治疗原发性干燥综合征患者的有效性和安全性。临床研究结果显示,泰它西普可持续有效改善干燥综合征患者的临床症状,显示出良好的疗效和安全性。研究表明,自身反应性的B细胞过度活化是干燥综合征发病的重要病理基础。泰它西普是由荣昌生物自主研发的重组B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点融合蛋白,通过同时抑制BLyS和APRIL与B细胞表面受体结合,阻止B细胞异常分化和成熟,有效减轻机体的病理性免疫反应。
(7)正大天晴首次公布HER2双抗TQB2102治疗肺癌2期临床数据
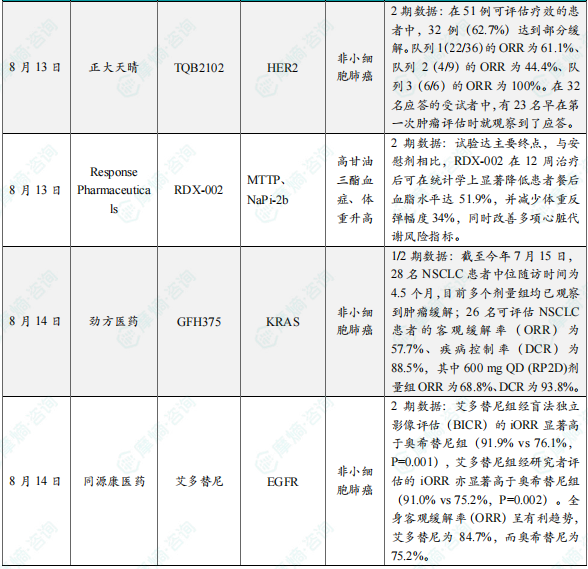
8月13日,2025年世界肺癌大会(WCLC 2025)常规摘要正文发布。正大天晴在大会上首次公布了HER2双抗ADC产品TQB2102治疗非小细胞肺癌(NSCLC)的 II 期临床研究数据。TQB2102是一款HER2双抗ADC,采用双表位设计,通过同时结合HER2阳性肿瘤细胞表面的ECD2、ECD4,增强药物内化效率,提升对肿瘤细胞的杀伤作用。此次在大会上公布的II期研究旨在评估 TQB2102在至少接受过一线治疗的局部晚期或转移性HER2基因异常 NSCLC 患者中的疗效。结果显示,在51例可评估疗效的患者中,32例(62.7%)达到部分缓解。队列1(22/36)的ORR为61.1%、队列 2(4/9)的ORR为44.4%、队列3(6/6)的ORR为100%。在32名应答的受试者中,有23名早在第一次肿瘤评估时就观察到了应答。
(8)Response Pharmaceuticals公布RDX-002 2期临床积极结果
8月13日,Response Pharmaceuticals宣布,其在接受GLP-1受体激动剂减重治疗完成后的患者中开展的临床2期试验取得积极结果。这项双盲、安慰剂对照研究共纳入68名受试者,旨在评估RDX-002单药在曾接受GLP-1减重疗法人群中的安全性、疗效及代谢影响。RDX-002是一种在研的肠道微粒体甘油三酯转运蛋白(iMTP)选择性小分子抑制剂,iMTP是参与肠道膳食甘油三酯和胆固醇吸收的关键伴侣蛋白。分析显示,试验达主要终点,与安慰剂相比,RDX-002在12周治疗后可在统计学上显著降低患者餐后血脂水平达51.9%,并减少体重反弹幅度34%,同时改善多项心脏代谢风险指标。此外,研究中RDX-002的安全性与耐受性良好,无严重不良事件(SAE)或因不良事件(AE)导致的停药,这与以往研究结果一致。
(9)劲方医药公布GFH375治疗肺癌最新1/2期临床数据
8月14日,劲方医药宣布小分子KRAS G12D抑制剂GFH375单药治疗非小细胞肺癌(NSCLC)患者的最新临床研究数据入选世界肺癌大会(WCLC)突破性研究摘要(LBA)及小型口头报告。1/2期研究显示GFH375治疗KRAS G12D突变实体瘤患者的整体安全性良好,并在NSCLC患者治疗中显示突出疗效、及安全性/耐受性良好。GFH375于2024年6月获批进入1/2期中国国内临床试验,目前已有142名KRAS G12D突变患者接受GFH375单药治疗,其中包括28名NSCLC(均为肺腺癌)患者及85名胰腺导管腺癌(PDAC)患者。截至今年7月15日,28名NSCLC患者中位随访时间为4.5个月,目前多个剂量组均已观察到肿瘤缓解;26名可评估NSCLC患者的客观缓解率(ORR)为57.7%、疾病控制率(DCR)为88.5%,其中600 mg QD (RP2D)剂量组ORR为68.8%、DCR为93.8%。
(10)同源康医药公布艾多替尼vs奥希替尼2期研究数据
8月14日,同源康医药公布了EGFR抑制剂艾多替尼(TY-9591)对比奥希替尼一线治疗EGFR变异型非小细胞肺癌(NSCLC)的关键性II期注册临床试验(ESAONA)结果。ESAONA研究是一项开放标签、多中心、随机II期临床试验,重点关注具有EGFR突变(L858R或19Del)和脑转移的患者,旨在比较艾多替尼(160mg,每日1次)对比奥希替尼(80mg,每日1次)一线治疗未经治疗的存在EGFR敏感突变且伴脑转移NSCLC患者的疗效和安全性。研究的主要终点为颅内客观缓解率(iORR)和颅内无进展生存期(iPFS)。截至2025年2月28日,研究共入组257例伴脑转移EGFR突变型NSCLC患者。基于224例受试者的中期分析显示,艾多替尼组经盲法独立影像评估(BICR)的iORR显著高于奥希替尼组(91.9% vs 76.1%,P=0.001),艾多替尼组经研究者评估的iORR亦显著高于奥希替尼组(91.0% vs 75.2%,P=0.002)。全身客观缓解率(ORR)呈有利趋势,艾多替尼为84.7%,而奥希替尼为75.2%。iPFS、PFS、OS等疗效数据尚未成熟。安全性方面,艾多替尼组3级及以上治疗相关不良事件(TRAE)发生率为31.5%,奥希替尼组为15.0%。艾多替尼组最常见的3级及以上不良反应包括肌酸磷酸激酶升高、QTcf间期延长、粒细胞减少、白细胞减少等。间质性肺疾病(ILD)发生率为9.9%,QTcf延长发生率为4.5%,均在可控制范围内。
同期事件:
1. 2025年第33周08.11-08.17国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第33周08.11-08.17国内仿制药/生物类似物申报/审批数据分析
3.2025年第33周08.11-08.17国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.08.11-2025.08.17) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论